
Prozessbeschleunigung und Hygienisierung in Biogasanlagen durch Vorschaltung einer Hydrolysephase/-stufe
Durch eine Trennung des Biogasprozesses in eine Hydrolyse- und eine Methanogenese-Phase lässt sich die Wahl der Ausgangssubstrate flexibilisieren.
Zielsetzung
 Zoombild vorhanden
Zoombild vorhanden
Liegende (40L) und stehende (70L) Fermenter in einer Versuchshalle
Es sollte untersucht werden, ob es diese Verfahrensführung beim Betrieb mit Maissilage gestattet, die Prozessdauer im Durchflusssystem zu reduzieren und die Abbauleistung zu steigern, ohne dass in der vorgeschalteten Versäuerungsstufe nennenswert Methan gebildet wird. Insbesondere sollten der Einfluss der Verweilzeit und des pH-Werts auf die Hydrolyse sowie Effekte des Einsatzes von Aufwuchskörpern im Methanreaktor geprüft werden.
Weiterhin sollte die abtötende Wirkung verschiedener anaerober Prozesse auf Salmonellen in Abhängigkeit von Temperatur und Verweilzeit bestimmt werden. Dabei galt es auch zu untersuchen, ob der Einbau molekularbiologischer Methoden in die Analytik eine schnellere und spezifischere Routine in der Praxis ermöglicht.
Weiterhin sollte die abtötende Wirkung verschiedener anaerober Prozesse auf Salmonellen in Abhängigkeit von Temperatur und Verweilzeit bestimmt werden. Dabei galt es auch zu untersuchen, ob der Einbau molekularbiologischer Methoden in die Analytik eine schnellere und spezifischere Routine in der Praxis ermöglicht.
Methode
 Zoombild vorhanden
Zoombild vorhanden
Aufwuchskörper für Mikroorganismen
Für die Versuche zur zweiphasigen Betriebsweise mit Maissilage wurden zwei zweistufige Fermenter-Systeme bestehend aus einem liegenden Fermenter (40L, 55°C, Hydrolysestufe, Hydrolyse/Acidogenese) und einem stehenden Fermenter (70L, 38°C, Methanstufe Acetogenese/Methanogenese) semikontinuierlich bei konstanter Raumbelastung mit Maissilage beschickt. Abhängig vom Experiment wurden unterschiedliche pH-Werte oder Verweilzeiten eingestellt.
Zusätzlich wurde das Rührwerk einer Methanstufe mit Aufwuchskörpern aufgerüstet (s. Abbildung). Für die Populationsanalysen methanbildender Archaeen wurde DNA des Schlüsselenzyms der Methanogenese (mcrA/mrtA) aus der freien Prozessflüssigkeit und aus dem Biofilm sequenziert. Zur Quantifizierung wurde die Real-Time PCR mit mcrA/mrtA als Zielgen eingesetzt.
Bei den Untersuchungen zur Hygienisierung wurden Salmonellen mit Gärgemisch in Keimträger eingesetzt und in unterschiedlich betriebenen Fermentern zeitabhängig exponiert (mesophil, thermophil, Maissilage, Grassilage). Zur Optimierung der Analytik wurde untersucht, ob die Integration einer spezifischen invA-qPCR-Routine in den konventionellen Kultivierungsablauf verlässliche Ergebnisse liefert. Weiterhin wurde eine Reihe von Praxis- und Technikums-Biogasanlagen mit kultivierungsbasierter und qPCR-Analytik auf Salmonellen untersucht.
Zusätzlich wurde das Rührwerk einer Methanstufe mit Aufwuchskörpern aufgerüstet (s. Abbildung). Für die Populationsanalysen methanbildender Archaeen wurde DNA des Schlüsselenzyms der Methanogenese (mcrA/mrtA) aus der freien Prozessflüssigkeit und aus dem Biofilm sequenziert. Zur Quantifizierung wurde die Real-Time PCR mit mcrA/mrtA als Zielgen eingesetzt.
Bei den Untersuchungen zur Hygienisierung wurden Salmonellen mit Gärgemisch in Keimträger eingesetzt und in unterschiedlich betriebenen Fermentern zeitabhängig exponiert (mesophil, thermophil, Maissilage, Grassilage). Zur Optimierung der Analytik wurde untersucht, ob die Integration einer spezifischen invA-qPCR-Routine in den konventionellen Kultivierungsablauf verlässliche Ergebnisse liefert. Weiterhin wurde eine Reihe von Praxis- und Technikums-Biogasanlagen mit kultivierungsbasierter und qPCR-Analytik auf Salmonellen untersucht.
Ergebnisse
Stabile Hydrolysestufe
Eine hydrolytisch/acidogene Phase konnte mit Maissilage als einzigem Substrat stabil ohne nennenswerte Methanbildung betrieben werden. Leicht abbaubare Inhaltstoffe wie Stärke, Zucker, Rohfett und Rohprotein wurden nahezu vollständig verflüssigt und u.a. zu Fettsäuren abgebaut. Hemicellulose und Cellulose verblieben weniger angegriffen in einer festen Phase.
pH-Wert
Ein höherer pH-Wert war die Schlüsselgröße für eine effizientere Hydrolyse und Acidogenese. Bei pH-Werten von 5,8 bis 6,2 wurden bis zu 22 g Essigsäureäquivalente (HAceq) * kgFM -1 gebildet und die Maissilage dabei bis zu 65% abgebaut (Verweilzeit: 10 d; Raumbelastung: 8 kgoTS * m-3 * d-1). Bei pH-Werten unter 4,6 wurden bei gleicher Verweilzeit und Raumbelastung maximal 6 g HAceq * kgFM -1 bei einem Abbau der Maissilage von 50 - 60% gebildet. Gleichzeitig intensivierte der höhere pH-Wert die Cellulose-Abbaurate und die Wasserstoff-Produktion aber auch die Methanbildung in der Hydrolysestufe.
Zugabe von separierter flüssiger und fester Phase
Die Zugabe der separierten flüssigen Phase in die Methanstufe lieferte schnell Biogas mit einem hohen Methangehalt (75%) und eine Methanausbeute von 240L * (kgoTS) -1. Bei Zusatz der flüssigen und der festen Phase in die Methanstufe (pH in der Hydrolysestufe 5,8 - 6,2) wurden in 43 d 91% des anaerob abbaubaren Substratanteils zu gasförmigen Energieträgern umgesetzt (298LN * kgoTS-1; 85% CH4, 6% H2). Der Methangehalt lag hier bei 60%.
Geschwindigkeit
Wenn die Prozessgeschwindigkeit das Hauptziel von Optimierungsmaßnahmen ist, ist die 2-phasige Vergärung dem 1-phasigen Betrieb mit Maissilage überlegen, allerdings verringert sich dabei die Effizienz des Substratumsatzes zu Energie. Entgegen der Lehrbuchmeinung scheinen Hydrolyse und Acidogenese nicht im sauren Bereich sondern bei höheren pH-Werten intensiver zu verlaufen.
Methanbildende Archaeen
Die Konzentration methanogener Archaeen war in der Hydrolysephase im Vergleich zur methanogenen Phase sehr klein. Die Anwesenheit von Aufwuchskörpern in der methanogenen Phase stabilisierte die Konzentration der Methanogenen bei Verringerung der Verweilzeit bzw. Erhöhung der Auswaschungsrate. Bei geringerer Verweilzeit nahm mit Vertretern vor allem der Ordnung Methanobacteriales auch die Diversität der methanogenen Archaeen in der methanogenen Phase ab. Im Biofilm reicherte sich dagegen die langsam wachsende Methanosaeta concilii ssp. 2 an und Methanoculleus II sp. 2, den wir als Säurezeiger ansehen.
Abtötung von Salmonellen
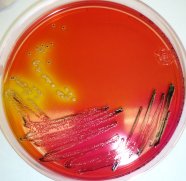 Zoombild vorhanden
Zoombild vorhanden
Salmonella enterica sv. Senftenberg W775 auf XLD-Agar
Hohe Temperaturen (thermophil) wirkten stark hygienisierend, bei 60°C konnten schon nach 30 min keine Salmonellen mehr nachgewiesen werden. Im mesophilen Betrieb verlief die Hygienisierung erwartungsgemäß wesentlich langsamer, die Reduktion entsprach aber in allen Fällen mehr als 99,9%. In Mono-Mais-Fermentern betrug die dezimale Reduktionszeit 8,3 h, der Prozess mit Grassilage wirkte anfangs stärker abtötend.
Verkürzte Analysezeit
Durch die Kombination der konventionellen Kultivierung bis zum Hauptanreicherungsschritt mit einer MPN-qPCR konnte eine merkliche Verkürzung der Analysezeit bei hochspezifischem Ergebnis erreicht werden. Die aus diesem Verfahren gewonnenen Reduktionsverläufe zeichneten die aus der reinen Kultivierungsmethode erhaltenen Ergebnisse gut nach. Die Messung residualer DNA inaktivierter bzw. toter Salmonellen konnte bei diesem Verfahren praktisch ausgeschlossen werden, und vorgeschädigte aber wachstumsfähige Zellen konnten sich während der zwei Kultivierungsschritte erholen.
Im Rahmen einer Produktprüfung wurden verschiedene Gärgemische bzw. Gärreste aus Versuchs- und Praxis-Biogasanlagen mit der kultivierungsbasierten Methode untersucht. Zur Überprüfung der Kolonien-Identität wurde eine spezifische qPCR auf Salmonellen durchgeführt. Das Screening ergab durchwegs negative Befunde.
Im Rahmen einer Produktprüfung wurden verschiedene Gärgemische bzw. Gärreste aus Versuchs- und Praxis-Biogasanlagen mit der kultivierungsbasierten Methode untersucht. Zur Überprüfung der Kolonien-Identität wurde eine spezifische qPCR auf Salmonellen durchgeführt. Das Screening ergab durchwegs negative Befunde.
Projektinformation
Die verfahrenstechnischen Inhalte wurden durch das Institut für Landtechnik und Tierhaltung (ILT2a) und die mikro- und molekularbiologischen Fragestellungen durch die Abteilung Qualitätssicherung und Untersuchungswesen (AQU1c) bearbeitet.
Projektleitung: Dr. Michael Lebuhn, Dr. Hauke Heuwinkel, Dr. Andreas Gronauer
Projektbearbeitung: Carmen Marín Pérez, Bianca Fröschle, Vasileios Dandikas
Elena Madge-Pimentel, Bernhard Munk, Sabine Topor, Robert Beck
Laufzeit: 2008 - 2011
Finanzierung: Bayerisches Staatsministerium für Ernährung, Landwirtschaft und Forsten
Die verfahrenstechnischen Inhalte wurden durch das Institut für Landtechnik und Tierhaltung (ILT2a) und die mikro- und molekularbiologischen Fragestellungen durch die Abteilung Qualitätssicherung und Untersuchungswesen (AQU1c) bearbeitet.
Projektleitung: Dr. Michael Lebuhn, Dr. Hauke Heuwinkel, Dr. Andreas Gronauer
Projektbearbeitung: Carmen Marín Pérez, Bianca Fröschle, Vasileios Dandikas
Elena Madge-Pimentel, Bernhard Munk, Sabine Topor, Robert Beck
Laufzeit: 2008 - 2011
Finanzierung: Bayerisches Staatsministerium für Ernährung, Landwirtschaft und Forsten


