Monitoring von gefährlichen Virus- und Viroidinfektionen von Hopfen in Deutschland (Projekt)
Viren und Viroide sind eine Gefahr für die Produktion von Hopfen. Derzeit besonders gefürchtet sind zwei Viroide, das Hopfenstaucheviroid (Hop stunt viroid, HpSVd) und Citrus bark cracking viroid (CBCVd), auch genannt Zitrusviroid IV (CVd IV) genannt.
Nur gesunder Hopfen liefert gesicherten Ertrag und beste Brauqualität. Oberstes Ziel ist deshalb der Anbau leistungsstarker, möglichst gering mit Krankheitserregern belasteter Hopfen. Problematisch ist jedoch, dass der Hopfen von einer Vielzahl von Schädlingen und Krankheiten befallen werden kann. Die Resistenzzüchtung hat am Hopfenforschungszentrum Hüll der Bayerischen Landesanstalt für Landwirtschaft (LfL) deshalb seit jeher oberste Priorität, so dass die Züchtung Pilz- und Blattlaus-resistenter Sorten im Fokus der Züchtungsarbeiten in Hüll steht. Im Hinblick auf Viren und Viroide ergeben sich jedoch besondere Schwierigkeiten: Viren und Viroide können nicht direkt mir Pflanzenschutzmitteln bekämpft werden und wirkungsvolle Resistenzgene gegen Viren und Viroide zur Einkreuzung stehen derzeit nicht zur Verfügung. Dabei können Virus- und Viroidinfektionen, die meist erst unter Stressbedingungen offensichtlich werden, abhängig von Befallsstärke und Sortenanfälligkeit zu deutlichen Ertragseinbußen und zur Reduktion des Alphasäurengehalts führen.
Viroide und Viren sind im Hopfen verbreitet und bedrohen den Hopfenanbau weltweit. Aufgrund des grenzübergreifenden Austausches von Hopfen können auch neue Viren und Viroide sehr leicht in die deutsche Hopfenproduktion gelangen. Die Infektion bleibt vielfach lange Zeit unerkannt, wird im Zuge der im Hopfenbau üblichen intensiven Kulturmaßnahmen mechanisch weitergetragen und leicht von Pflanze zu Pflanze und von Bestand zu Bestand verschleppt. Für ein effektives Krankheitsmanagement ist es dann zu spät, da Viroide und Viren nicht direkt zu bekämpfen sind. Befall kann den Ertrag und Alphasäurengehalt gravierend mindern und erhebliche wirtschaftliche Verluste verursachen. Insbesondere bei Viroidbefall kann es notwendig sein, auf betroffenen Flächen Hopfen zu roden, wie das in Slowenien bereits der Fall war (Jakse et al. 2015).
Unser deutschlandweites Monitoring auf Viren und Viroide ist ein wertvolles Werkzeug der Vorbeugung; es gibt Aufschluss über die Verbreitung dieser Schaderreger und deckt erste Befallsherde auf. So kann Erstbefall getilgt werden, noch bevor sich ein neuer Erreger flächenmäßig ausgebreitet und etabliert hat. Dies gilt insbesondere für das gefürchtete Hopfenstaucheviroid (HpSVd) und das unlängst erstmals in Slowenien und im Sommer 2019 auch in Deutschland an Hopfen nachgewiesene Citrus bark cracking viroid (CBCVd) (Radisek et al. 2013). Beide Viroide können zusammen drastische Schadbilder verursachen und massive Schäden bedingen. Dabei ist das CBCVd das aggressivere Viroid und kann zum Absterben der Pflanzen binnen weniger Jahre führen.
Ziel
In unserem Monitoring sollen primäre Befallsherde neuer Erreger wie CBCVd (Citrus bark cracking viroid) und HpSVd (Hopfenstaucheviroid) aufgedeckt und getilgt werden. Zudem soll die derzeitige Viroid- und Virussituation im deutschen Hopfenbau erfasst und bewertet werden.
Methode
Die Monitoringproben stammen aus allen bedeutenden Hopfenanbauregionen Deutschlands: Hallertau, Gebiet um Tettnang wie auch Elbe-Saale-Region. Beprobt werden Praxisflächen, weibliche und männliche Hopfen der Züchtungsgärten der LfL, das Hüller Sortenregister und der Vermehrungsbetrieb der Gesellschaft für Hopfenforschung (GfH); auch Wildhopfen der Hüller Wildhopfensammlung werden mit einbezogen. Zudem werden importiertes Zuchtmaterial, ausländische Sorten, Material aus ehemaligen oder aktuellen HpSVd-Befallsgebieten (Japan, Korea, China, USA, Slowenien) sowie unter Quarantänebedingungen gehaltene Pflanzen aus Befallsgebieten getestet. Wegen der hohen Kosten für die Testung erfolgt das Monitoring nicht flächendeckend, sondern nur stichprobenartig an repräsentativen und wichtigen Standorten.
Die Probenahme erfolgt durch die Hopfenbauberater vor Ort wie auch durch die Kolleginnen und Kollegen der LfL. In der Regel sind zwei Pflanzen pro Schlag zu beproben. Dabei sind Blätter aus den obersten 2-3 Blattetagen zu entnehmen bzw. ist der entsprechende Trieb mit den Blättern abzureißen. Nach Möglichkeit sollen Pflanzen mit verdächtigem Erscheinungsbild ausgewählt werden, z. B. mit Stauchungen, gelblichen Sprenkelungen, eingerollten Blättern oder Pflanzen mit auffällig kleinen Blättern, deren Erscheinungsbild insbesondere dem HpSVd-infizierter Hopfen ähnelt, mit dem Ziel, bestehende Infektionsherde möglichst frühzeitig aufzudecken. Es handelt sich demzufolge um ein „gezieltes“ und nicht um ein "zufälliges" Monitoring.
Hinweise zur Probenahme und zur Einsendung von Proben ![]() 233 KB
233 KB
Das Probenmaterial wird schnellst möglich zum Diagnoselabor der LfL nach Freising gebracht oder per Post geschickt, dort für die spätere Testung aufbereitet und anschließend sofort bis zur weiteren Untersuchung bei minus 80 °C gelagert.
Das Spektrum an zu untersuchenden Viren und Viroiden war in den Anfangsjahren des Projekts breit angelegt, so dass nicht nur auf Viroide, sondern auch auf eine Reihe von Hopfenviren getestet wurde. Die Virustests erfolgten primär über ELISA, für die Viroidtestung kommen molekularbiologischen Verfahren zum Einsatz. In den späteren Jahren des Monitorings erfolgen ausschließlich Tests auf CBCVd und HpSVd.
Molekularbiologischer Nachweis
- Latentes Hopfenvirus (Hop latent virus, HpLV)
- Latentes Amerikanisches Hopfenvirus (American hop latent virus, AHpLV)
- Hopfenstaucheviroid (Hop stunt viroid, HpSVd)
- Citrus bark cracking viroid (CBCVd) = Zitrusviroid IV (CVd IV)

Konventionelle RT-PCR (Reverse Transkriptase Polymerase-Kettenreaktion)
Der Viroid- und Virusnachweis erfolgt durch Auftrennung und Sichtbarmachen der charakteristischen RT-PCR-Produkte auf einem Agarose-Elektrophoresegel. Für den Nachweis der Viroide (HpSV, CBCVd) und Viren (HpLV, AHpLV) kommen jeweils viroid- bzw. viruspezifische Primer (Startermoleküle für die RT-PCR) zur Anwendung.
 Zoombild vorhanden
Zoombild vorhanden
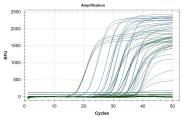
Anstieg der Fluoreszenzstrahlung (RFU) bei der Realtime RT-PCR.
Zusätzlich zum spezifischen Viroid- und Virusnachweis wird bei jeder einzelnen Probe eine Kontrolle zum Nachweis von Pflanzen-RNA mitgeführt. Da Pflanzen-RNA in jeder Probe enthalten ist und deshalb in jeder Probe nachweisbar sein muss, dient diese Kontrolle dem Ausschluss „falsch negativer“ Ergebnisse (Seigner et al. 2008): Ist der Nachweis von Pflanzen-RNA in einer Probe nicht möglich (beispielsweise weil Pflanzeninhaltsstoffe die PCR hemmen), so ist das ein negatives Viroid- oder Virusergebnis nicht aussagekräftig.
Serologischer Nachweis über DAS-ELISA (Doppel-Antikörper-Sandwich-Enzyme Linked ImmunoSorbent Assay)
- Apfelmosaikvirus
- Arabismosaikvirus
- Hopfenmosaikvirus

Der Nachweis mittels RT-PCR und Realtime RT-PCR ist sehr zuverlässig und unabhängig von Symptomen, die im Falle von HpSVd erst 3 bis 5 Jahre nach der Infektion auftreten. Im Falle einer positiven RT-PCR auf CBCVd oder HpSVd ist es zumindest bei Neubefall zur endgültigen Befallsfeststellung notwendig, die RT-PCR-Reaktionsprodukte aufzureinigen und in einem Auftragslabor die genetische Sequenz bestimmen zu lassen. Besteht weitestgehende Übereinstimmung in der genetischen Sequenz mit bekannten in GenBank® hinterlegten Gensequenzen, so ist Viroidbefall bestätigt.
Maßnahmenkatalog
Ergebnisse
Monitoringjahr 2019
 Zoombild vorhanden
Zoombild vorhanden
Amplifikationskurven der Realtime RT-PCR bei Testung auf CBCVd: Testung einer Verdünnungsreihe
Monitoringjahr 2018
Die interne Realtime RT-PCR-Kontrolle erbrachte bei jeder Probe ein eindeutig positives Ergebnis. Dies belegt, dass mit dem Realtime RT-PCR-Testverfahren ein stabiler und zuverlässiger Nachweis sichergestellt ist.
 Zoombild vorhanden
Zoombild vorhanden
Nachweis des Hopfenstauche-Viroids und der internen Kontrolle mittels Realtime RT-PCR und Taqman-Gensonden. Grüne Kurven: Interne Kontrolle; blaue Kurven: HpSVd-Nachweis; flache Kurven = Negativkontrollen.
Monitoringjahr 2017
Einen wesentlichen Arbeitsschwerpunkt stellte 2017 die Erarbeitung, Weiterentwicklung und Praxiserprobung hoch sensitiver Realtime RT-PCR-basierter Verfahren für Hopfenviroide und -viren dar, die den Nachweis sicherer und schneller machen. Die komplexe Pflanzenmatrix des Hopfens war dabei eine besondere Herausforderung. An der LfL wurden bereits für eine Reihe von Erregern solch moderne Nachweismethoden etabliert, validiert und so für Routinediagnosen nutzbar gemacht.
Da die ersten Ergebnisse im Hinblick auf das Hopfenstauche-Viroid (HpSVd) und das Citrus bark cracking viroid (CBCVd, = Zitrus-Viroid, CVd IV) erfolgversprechend waren, wurden im Monitoringjahr 2017 erstmals alle Monitoringproben mit der Realtime RT-PCR unter Verwendung von HpSVd- und CBCvd-spezifischen Primern und Taqman-Gensonden getestet. Bei jeder Probe wurde zusätzlich eine interne, auf Pflanzen-mRNA-basierende Positivkontrolle mit untersucht. Der Viroid-spezifische Nachweis und der Nachweis der internen Positivkontrolle erfolgten im selben Realtime RT-PCR-Ansatz.
2017 wurde in keiner der 362 untersuchten Proben das Hopfenstauche-Viroid oder das Zitrus-Viroid nachgewiesen. Die interne Realtime RT-PCR-Kontrolle hat bei jeder Probe funktioniert. Dies zeigt ganz klar, dass mit dem neuen Realtime RT-PCR-Testverfahren ein stabiler und sicherer Nachweis in der Routine gewährleistet ist.
Monitoringjahr 2016
Auch die deutsche Hopfenproduktion wird durch zwei gefährliche Viroide, das Hop stunt viroid (HpSVd) und das Citrus bark cracking viroid (CBCVd = Zitrusviroid IV, CVd IV), bedroht (Jakse et al. 2015). Diese sehr leicht zu verschleppenden und nicht bekämpfbaren Viroide können hohe wirtschaftliche Verluste und Qualitätseinbußen verursachen. Das deutschlandweite Viroidmonitoring der LfL leistet einen wesentlichen Beitrag zur Prävention und Sicherung der Hopfenproduktion in Deutschland: Es ermöglicht, Erstbefall zu erkennen, primäre Befallsherde zu tilgen und eine flächenmäßige Verbreitung der gefürchteten Pathogene zu verhindern.
 Zoombild vorhanden
Zoombild vorhanden
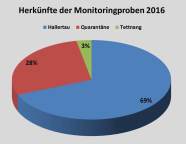
Herkünfte der Monitoringproben des Jahres 2016
2016 wurde in keiner der 327 analysierten Probe wurden HpSVd oder CBCVd nachgewiesen. Beide gefährlichen Viroide konnten also noch keinen Einzug in den deutschen Hopfenanbau finden. Die Viroidgefahr ist jedoch aufgrund der weltweiten Befallssituation, des Imports sowie innergemeinschaftlichen Verbringens von Pflanzgut aus Befallsgebieten und fehlender Quarantäneregulierung weiterhin überaus groß. Das an der LfL durchgeführte Monitoring leistet zwar einen wesentlichen Beitrag zur Überwachung der Viroid-Befallssituation, dennoch ist das Monitoringraster relativ grob, sodass möglicherweise bereits bestehende Befallsnester noch nicht detektiert worden sind. Immer wieder werden in eingeführten Hopfen aus Befallsgebieten HpSVd-Infektionen festgestellt, wodurch die Problematik unterstrichen wird. Das massive Interesse der deutschen Hopfenpflanzer am Import und Anbau von Flavorhopfen aus den USA als HpSVd-Befallsland erhöht darüber hinaus das Einschleppungsrisiko beträchtlich. Die Testung insbesondere an Importhopfen und das Monitoring auf HpSVd und CBCVd werden deshalb konsequent und möglichst engmaschig fortgesetzt.
Monitoringjahr 2015
Im Monitoringjahr 2015 waren die Intensität der Probennahme und die Herkunft der Proben ähnlich wie in den Vorjahren. Im Gegensatz zu den Jahren 2011-2013 beschränkten sich 2015, wie auch schon 2014, die Tests auf HpSVd und CVd IV, das neuerdings Citrus bark cracking viroid (CBCVd) bezeichnet wird (Jakse et al. 2015). Auf die Testung auf die Hopfenviren AHpLV (Latentes Amerikanisches Hopfenvirus), ApMV (Apfelmosaikvirus), ArMV (Arabismosaikvirus), HpMV (Hopfenmosaikvirus) und HpLV (Latentes Hopfenvirus) wurde verzichtet, da die meisten dieser mechanisch und größtenteils durch Blattläuse übertragenen Hopfenviren, wie unsere Monitoringergebnisse der Vorjahre immer wieder zeigten, im deutschen Hopfengärten weit verbreitet sind. Allerdings spielt das ArMV im deutschen Hopfenanbau keine Rolle. Es wird empfohlen, bei der Anlage neuer Hopfengärten Pflanzmaterial zu verwenden, das auf Viren getestet ist, um zumindest in der Anfangsphase ein höheres Ertragsniveau zu erreichen. Insbesondere das ApMV und das HpMV können wirtschaftliche Einbußen verursachen, vor allem wenn sie in Mischinfektionen - auch mit anderen Viren - auftreten.
2015 wurden insgesamt 213 Hopfenpflanzen beprobt. 32 der beprobten Pflanzen wiesen dabei Auffälligkeiten bzw. verdächtige Symptome auf wie z. B. Vergilbung, schlechten Wuchs, eingerollte Blätter oder wurden insgesamt als „schwach“ eingestuft. Der Großteil der Proben stammte aus Deutschlands größtem Hopfenanbaugebiet, der Hallertau; 10 Proben wurden aus Tettnang eingereicht.
In keiner der im Jahr 2015 analysierten Proben wurde HpSVd oder CBCVd gefunden. Beide Viroide haben also noch keinen Einzug in den deutschen Hopfenanbau gefunden. Im Hinblick auf CBCVd, das vermutlich über Abfälle von Zitrus in Slowenien in den Hopfen eingeschleppt worden war (Radišek et al. 2013), ist zu betonen, dass 14 beprobte Hopfen mit Kompost gedüngt worden waren, 10 davon mit Biokompost. In keiner dieser Proben wurde CBCVd nachgewiesen. Wird Kompost in Hopfengärten ausgebracht, so ist es grundsätzlich wichtig, dass die Kompostierung unter optimalen Bedingungen vonstattengeht und die zur aeroben Hygienisierung notwendige Temperatur gleichmäßig im Komposthaufen verteilt ist. Allerdings spielt bei der Inaktivierung der Viroide in einer Kompostanlage nicht nur die Temperatur, sondern insbesondere auch das Zusammenwirken chemischer, biochemischer und biophysikalischer Vorgänge eine entscheidende Rolle (Radišek, persönliche Mitteilung). Die Frage, inwieweit ein Risiko bei der Ausbringung von Kompost besteht, ist noch endgültig zu klären.
Monitoringjahr 2014
Das Monitoringprogramm der letzten Jahre wurde 2014 im Hinblick auf die Beprobungsdichte und räumliche Verteilung der Probenahme wie in den Vorjahren fortgesetzt. Lediglich aus der Elbe-Saale-Region wurden keine Proben eingereicht. Im Gegensatz zu den Jahren davor beschränkten sich 2014 die Tests auf das HpSVd und CBCVd, da die weite Verbreitung der Hopfenviren durch die Monitoringergebnisse der Jahre 2011-2013 hinlänglich belegt ist. Insgesamt wurden 239 Proben untersucht. Das 2013 an der LfL neu etalierte Verfahren zum Nachweis des CBCVd wurde erfolgreich bei der Testung aller Proben eingesetzt. In keiner der im Jahr 2014 analysierten Proben wurde HpSVd oder CBCVd gefunden.
Monitoringjahr 2013
Im Monitoringjahr 2013 wurden insgesamt 279 Hopfen auf HpSVd (Hop stunt viroid = Hopfenstauchviroid) bzw. annährend 240 Proben auf das Apfelmosaikvirus (ApMV, Apple mosaic virus), das Arabismosaikvirus (ArMV, Arabis mosaic virus), das Hopfenmosaikvirus (HpMV, Hop mosaic virus) sowie das Latente Amerikanische Hopfenmosaikvirus (AHpLV, American hop latent virus) analysiert. Zwölf Proben, für die ein spezielles Risiko bestand, wurden auf das in Slowenien (Radišek 2013) unlängst nachgewiesene, äußerst aggressive Citrus bark cracking viroid (CBCVd = CVd IV, Zitrusviroid IV) getestet.
In keiner der auf HpSVd und CBCVd untersuchten Proben wurde eines der beiden gefürchteten Viroid nachgewiesen. Allerdings war die Anzahl der im Jahr 2013 auf CBCVd getesteten Proben zu gering, um von einer verlässlichen Datenbasis sprechen zu können. Diese Tests wurden in den Folgejahren intensiviert.
 Zoombild vorhanden
Zoombild vorhanden
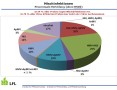
Virusmonitoring im Hopfen - Ergebnisse aus 2013
Besonders bemerkenswert ist, dass von den 62 % infizierten Hopfen 34 % mit einem und 29 % mit bis zu drei Viren infiziert waren. AHpLV kam zusammen mit ApMV (3 %) bzw. HpMV (6 %) vor. Die als ertragsrelevant betrachtete Mischinfektion von HpMV und ApMV (ohne AHpLV) war in 10 % der Hopfen nachweisbar. Darüber hinaus war bei 9 % aller Infektionen der Hopfen mit HpMV, ApMV und zusätzlich mit AHpLV befallen. Der Anteil an Mehrfachinfektionen könnte sogar noch höher liegen, da 2013 auf das bekanntermaßen häufig auftretende HpLV nicht getestet worden war.
Monitoringjahr 2012
2012 wurden insgesamt wurden 230 Hopfen auf HpSVd bzw. 229 auf Viren analysiert. Das gefährliche HpSVd wurde in keiner einzigen Probe detektiert.
Wie schon 2011 wurden Viren in erheblichem Ausmaß in den Monitoringproben festgestellt; da bevorzugt Hopfen mit Symptomen untersucht wurden, wird die tatsächliche Befallslage möglicherweise überbewertet. In nur 20 % aller Proben wurde kein Virus gefunden. Die als vergleichsweise kritisch eingestuften HpMV und ApMV wurden in 35 % bzw. 24 % der Proben nachgewiesen; das HpLV, das geringere Einbußen zu verursachen scheint und deshalb weitgehend toleriert wird, wurde in 59 % aller Fälle detektiert. Lediglich ArMV war mit einer Befallshäufigkeit von 2 % nur selten anzutreffen. In 9 von 53 stichprobenartig getesteten Proben konnte das AHpLV gefunden werden; folglich scheint auch dieses Virus in der Praxis verbreitet zu sein. Laut Angaben von Eastwell und Druffel (2012) mindert AHpLV den Dolden- und Alphasäurengehalt. Insgesamt waren fast 75 % aller Hopfen mit den Blattlaus-übertragbaren Carlaviren (HpMV und/oder HpLV; AHpLV nicht eingeschlossen) befallen. Hervorzuheben ist außerdem, dass in 36 % aller Proben Mischinfektionen mit verschiedenen Viren vorlagen. So waren z. B. 13 % aller Hopfen gleichzeitig mit HpMV und HpLV infiziert; in 6 % waren HpMV wie auch ApMV und in weiteren 6 % HpMV, HpLV und ApMV zusammen anzutreffen. Insbesondere Mischinfektionen mit HpMV und ApMV werden als ertragsrelevant betrachtet.
Monitoringjahr 2011
In keiner der im Jahr 2011 auf HpSVd untersuchten 280 Hopfenproben wurde das gefürchtete Viroid nachgewiesen.
Ein anderes Bild ergibt sich für den Großteil der getesteten Hopfenviren, obgleich durch die bevorzugte Beprobung symptomzeigender Hopfenpflanzen die tatsächliche Befallssituation möglicherweise überschätzt wird: Nur 42 von insgesamt 246 auf alle Viren (AHpLV bleibt unberücksichtigt wegen nicht in ausreichender Zahl durchgeführter Analysen) getesteten Hopfen, also knapp 17 % der beprobten Pflanzen, erwiesen sich als virusfrei.
HpLV wurde in 60 % von insgesamt 250 untersuchten Proben detektiert, HpMV in 66 % und ApMV in 36 % der analysierten Proben; lediglich ArMV fand sich in weniger als 1 % der Proben. In 6 von 10 stichprobenartig untersuchten Proben amerikanischen Ursprungs wurde das AHpLV mit der RT-PCR gefunden.
Hervorzuheben ist ferner, dass häufig Mischinfektionen mit unterschiedlichen Viren vorlagen. Vier verschiedene Viren wurden in zwei Proben detektiert: neben ArMV waren auch noch HpLV, HpMV sowie ApMV vorzufinden. In 50 von 246 analysierten Proben waren drei Viren gleichzeitig anwesend: neben den beiden Carlaviren HpMV und HpLV (AHpLV ist wegen der nur stichprobenartig durchgeführten Analysen dabei nicht berücksichtigt) war auch ApMV anzutreffen. In 61 Proben waren HpMV und HpLV zusammen anwesend. ApMV und HpMV waren in 25 Hopfen vergesellschaftet, HpLV und ApMV in 6. Jeweils nur ca. 11 % aller Proben waren allein mit HpLV oder allein mit HpMV und nur ca. 3 % ausschließlich mit ApMV infiziert.
Fazit aus den bisherigen Monitoring-Ergebnissen
Das gefährliche Hopfenstaucheviroid (HpSVd), das in anderen Ländern wie Japan, Korea, China, den USA und neuerdings auch Slowenien (Radišek et al. 2013) bereits relativ häufig nachgewiesen wurde und zu wirtschaftlichen Verlusten führte, ist trotz des weltweiten Austausches von Hopfenpflanzgut im deutschen Hopfenanbau noch nicht verbreitet. Diese Ergebnisse können als beruhigend gewertet werden, da sie zeigen, dass bislang noch kein HpSVd aus Ländern mit erhöhtem Infektionsdruck wie Japan in früheren Jahren und den USA, wo seit 2006 HpSVd-Infektionen bekannt sind, nach Deutschland eingeschleppt wurde. Dennoch gilt es, die Testung auf HpSVd fortzusetzen, da aufgrund der weltweiten Befallssituation die Gefahr einer Einschleppung permanent droht und möglicherweise bereits bestehende Befallsnester in unserem relativ groben Monitoringraster noch nicht detektiert worden sind.
Das Auftreten des gefürchteten Zitrusviroid IV (CVd IV = CBCVd, Citrus bark cracking viroid) in Slowenien (Jakse et al. 2015) verschärft die Problematik, so dass auch dieses Viroid im Fokus unseres Monitoringprogramms steht. Die Untersuchungen auf das CVd IV wurden 2013 begonnen und werden in den Folgejahren fortgeführt. Bislang wurde dieses gefährliche Viroid in keiner einzigen Probe detektiert.
Die Monitoringergebnisse der Jahre 2011-2013 belegen sehr augenfällig, dass im Gegensatz zu Viroidinfektionen Virusinfektionen an Hopfen im deutschen Hopfenanbau weit verbreitet sind. Die beiden Carlaviren Hopfenmosaikvirus (HpMV) und Latentes Hopfenmosaikvirus (HpLV) treten häufig auf. Der Anteil mit Apfelmosaikvirus (ApMV) infizierter Pflanzen, das insbesondere in Mischinfekton mit HpMV ertragsrelevant ist, ist ebenfalls beträchtlich. Das Arabismosaikvirus (ArMV), das die gefürchtete Nesselkopfkrankheit verursacht, wurde kaum detektiert; ArMV spielt also keine Rolle im Deutschen Hopfenanbau.
Das 2008 begonnene deutschlandweite Monitoring auf gefährliche Viroidinfektionen im deutschen Hopfenbau wird fortgeführt. Aufgrund der intensiven Testung besteht die realistische Chance, auch künftig HpSVd- und Zitrusviroidbefall aus deutschen Hopfengärten fernzuhalten. Aus methodischer Sicht stehen die Verbesserung der Nachweisverfahren und die Etablierung moderner Diagnosemethoden im Vordergrund.
Wie bereits in der Vergangenheit werden unsere für den Hopfenanbau sehr wichtigen Arbeiten dankenswerterweise weiterhin großzügig durch die Wissenschaftliche Station für Brauerei München e.V. gefördert.
- L. Seigner, A. Lutz, E. Seigner (2014): Monitoring of Important Virus and Viroid Infections in German Hop (Humulus lupulus L.) Yards, BrewingScience 67, 81-87
- L. Seigner, A. Lutz, E. Seigner (2015):Monitoring of dangerous viruses and viroids in German hop gardens. Brauwelt International 6, 376-379
- E. Seigner, L. Seigner, A. Lutz (2015): Monitoring von gefährlichen Viren und Viroiden in deutschen Hopfengärten. Brauwelt Wissen 26, 757-760
- L. Seigner, L. Keckel, J. Hüttinger, E. Seigner, J. Kneidl, A. Lutz (2016): Hopfenviroide – eine andauernde Gefahr. Hopfen-Rundschau 9, 338-339
- L. Seigner, M. Liebrecht, · L. Keckel, K. Einberger, C. Absmeier (2020): Real‑time RT‑PCR detection of Citrus bark cracking viroid (CBCVd) in hops including an mRNA‑based internal positive control. J Plant Dis Prot (2020). https://doi.org/10.1007/s41348-020-00317-x
Projektinformation
Projektleitung: Dr. Luitgardis Seigner, IPS 2c/Virologie; Dr. Elisabeth Seigner, Anton Lutz, IPZ 5c/Züchtungsforschung Hopfen
Projektbearbeitung: Carolin Absmeier, Christine Huber, Ulrike Stanglmaier, Sigrid Ziegltrum, Linda Keckel, Katharina Einberger, Marion Liebrecht, IPS 2c/Virologie; Jutta Kneidl, IPZ 5c/Züchtungsforschung Hopfen
Laufzeit: seit 2008
Finanzierung: 2008: Eigenmittel; 2009-2010: Erzeugergemeinschaft Hopfen HVG e.G.; 2011-2018: Wissenschaftliche Station für Brauerei in München e.V.; ab 2019: Eigenmittel
Kooperation: IPZ 5a/Hopfenbau, Produktionstechnik; Hopfenberater, Hopfenvermehrungsbetriebe, Dr. K. Eastwell, Washington State University, Washington, USA; Dr. S. Radisek, Slovenian Institute for Hop Research and Brewing, Žalec, Slowenien