Verticillium-Problematik bei Hopfen

Starke Welkesymptome an einer Hopfenrebe
Forschung und Arbeiten zur Verticillium-Problematik bei Hopfen
Seit etwa 20 Jahren tritt in einigen Regionen der Hallertau verstärkt die Verticillium-Welke auf. Verursacht wird diese Krankheit im Hopfen vor allem durch den Bodenpilz Verticillium nonalfalfae (ehemals: Verticillium albo-atrum) und eher selten durch Verticillium dahliae.
Aufgrund dessen wurden 2008 die Forschungsarbeiten zur Welkeproblematik im Hopfen an der Landesanstalt für Landwirtschaft wieder verstärkt aufgenommen. Bei diesen Arbeiten wurden neben den sogenannten milden Welkestämmen von Verticillium nonalfalfae zum ersten Mal auch aggressive Stämme in der Hallertau nachgewiesen. Sie führen auch bei früher als Welke-tolerant eingestuften Hopfensorten zu deutlichen Welkesymptomen und zum Absterben der Reben. Durch den Einsatz von Pflanzenschutzmitteln kann der Pilz nicht direkt bekämpft werden, daher müssen andere Lösungen gefunden werden, um langfristig einen nachhaltigen und qualitativ hochwertigen Hopfenanbau zu gewährleisten.
Hinweise für Hopfenpflanzer
Welke-Monitoring
Die LfL bietet in den Sommermonaten ein Welke-Monitoring an. Es wird unter anderem die betroffene Fläche besichtigt und mithilfe von Drohnenbildern die Befallsverteilung im Hopfengarten bewertet. Dabei steht der Erfahrungsaustausch im Mittelpunkt.
Kontakt
Katrin Lutz
Tel.: 08161 8640 2335

Drohnenbild einer befallenen Hopfenfläche
Untersuchung von Praxisproben auf Verticillium
Welke-verdächtige Hopfen können im Pilzdiagnose-Labor der LfL in begrenzter Zahl auf Verticillium-Befall untersucht werden. Die Kosten der Untersuchung belaufen sich auf 49,50 Euro pro Probe.
Details zur Probennahme
Zum Nachweis von Verticillium und anderer pathogener Pilze wird ein sogenannter Wachstumstest durchgeführt. Bei diesem Nachweis ist der Zustand des Probenmaterials ausschlaggebend. Um aussagekräftige Ergebnisse zu erzielen, muss bei der Probennahme auf folgende Punkte geachtet werden:
- Zeitraum der Probennahme: Juni – September
- Pflanze darf noch nicht abgestorben sein
- Optimale Ausgangspflanze hat bereits Symptome entwickelt, ist aber noch überwiegend lebensfähig
- Rebe 15 cm oberhalb des Bifangs abschneiden
- Rebenstücke (10 – 20 cm) in saubere Plastiktüte verpacken
- Auf möglichst geringen Erdanhang achten
- Bis zur Probenabgabe im Kühlschrank lagern
Beschriften Sie Proben-Tüte mit den notwendigen Informationen (Name, Sorte, Datum) und geben Sie mit der Probe einen Probenbegleitschein ab, der Ihre Kontaktdaten (Adresse, Tel. etc.) sowie Details zu Ihrer zu untersuchenden Probe enthält. Dieser Probenbegleitschein kann unter folgendem Link heruntergeladen werden:
Probenbegleitschein  99 KB
99 KB
Nach der Probennahme sollte das Pflanzenmaterial gekühlt und schnellstmöglich nach Freising gebracht werden. Melden Sie auf jeden Fall Ihre Proben vor der Beprobung in Freising unter 08161 8640 5651 an.
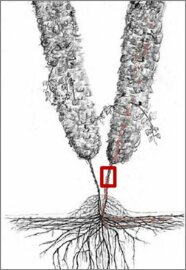
Der Rebenabschnitt innerhalb des roten Rahmens zeigt den idealen Rebenabschnitt (Teil der Pflanze/Rebe, ca. 15 cm) zur Probennahme.
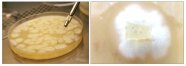
Labortest auf Verticillium: Petrischale mit weißem Pilzmyzel zur mikroskopischen Identifizierung von Verticillium
Projektinformation
Projektleitung: S. Euringer
Projektbearbeitung: K. Lutz und Team IPZ 5b
Kooperation:
Erzeugergemeinschaft Hopfen HVG e.G. (Selektionsgärten, Biologische Bodenentseuchung)
AG Züchtungsforschung Hopfen: Dr. S. Gresset (seit Jan. 2023), Dr. E. Seigner (bis Dez. 2021), A. Lutz, P. Hager, R. Enders, J. Kneidl und Team
AG Hopfenbau und Produktionstechnik: S. Fuß, A. Schlagenhaufer
Institut für Pflanzenschutz, Mykologie: Dr. P. Büttner
Slovenian Institute of Hop Research and Brewing: Dr. S. Radišek
Laufzeit: 01.06.2017 – 29.10.2023
Förderung: Gesellschaft für Hopfenforschung e.V.
Förderkennzeichen: 31/599
Projektinformation
Projektleitung: Dr. S. Gresset (seit Jan. 2023), Dr. E. Seigner (bis Dez. 2021); Dr. S. Seefelder (bis Okt. 2015)
Projektbearbeitung: A. Lutz, P. Hager, R. Enders, J. Kneidl und Team
Kooperationspartner:
Institut für Pflanzenschutz, Mykologie: Dr. P. Büttner
Institut für Pflanzenschutz, Virologie: Dr. V. Wetzel, Dr. L. Seigner (bis Dez. 2022)
Slovenian Institute of Hop Research and Brewing: Dr. S. Radišek
Laufzeit: seit 2008 – 29.10.2023
Förderung: Erzeugergemeinschaft Hopfen HVG e.G.
Förderkennzeichen: 31/575
Bedeutung für den Hopfenbau
Der Erreger der Hopfenwelke ist ein im Boden lebender Pilz mit einem breiten Wirtsspektrum. Dieser kann bis zu 5 Jahre im Boden in Form eines infektiösen Dauermyzels überdauern und ist mit keinem Pflanzenschutzmittel bekämpfbar.
Früher (1952 bis 2005)
Im deutschen Hopfenbau ist die Verticillium-Welke erstmalig seit Anfang der 1950er Jahre in seiner milden Form aufgetreten. Damals beschränkte sich der Anbau in der Hallertau auf die anfällige Landsorte Hallertauer Mittelfrüher. Bis 1964 waren etwa 3500 ha von der Krankheit betroffen. Durch eine Reduzierung des Düngeniveaus, den Anbau ausländischer Sorten (v.a. Northern Brewer) und die Züchtung von toleranteren Sorten (z.B. Perle) hielten sich die Schäden in Grenzen.
Heute
Seit dem ersten Auftreten von aggressiven Verticillium-Stämmen ist wieder eine kontinuierliche Ausbreitung der Befallsfläche im Anbaugebiet Hallertau zu beobachten. Seit 2005 zeigen selbst früher als Welke-tolerant eingestufte Hopfensorten wie Northern Brewer, Perle und Saphir massive Welkeschäden. Der vermehrte Anbau toleranter Sorten trägt zur natürlichen Selektion des Pilzes bei, weshalb das gesamte Sortenspektrum der Hallertau befallen werden kann.
Bekannte Regulierungsmaßnahmen zeigen nur noch mäßigen Erfolg, weshalb es zu zunehmenden finanziellen Einbußen für die Landwirte kommt.
Ziel des Forschungsprojekts
Zum besseren Management des Krankheitsbefalls sollen daher im Forschungsprojekt Hygienemaßnahmen, Züchtungsanstrengungen und Sanierungskonzepte umgesetzt werden. Neue, alternative Präventions- und Sanierungsmaßnahme zu finden, sowie die bestmögliche Umsetzung bereits bekannter Vorsorgemaßnahmen sind von zentraler Bedeutung bei der Bekämpfung der Verticillium-Welke im Hopfenbau.

Hopfengarten mit massiven Welkeschäden
Biologie des Welkepilzes und Infektion des Hopfens
Biologie
[Verticillium nonalfalfae ist ein Bodenpilz, der beim Hopfen die Welke-Krankheit verursacht. Der Pilz ist in lebenden und verrottenden Blättern, Reben und Wurzeln des Hopfens und im Boden zu finden. Sporen (Konidien) und die dunkel gefärbten Überdauerungsorgane (Myzelien) sind infektiöse Strukturen. Über sie erfolgt auch die Weiterverbreitung. Während Konidien nur 2 bis 4 Wochen überleben, bleibt das Infektionspotenzial des Myzels bis zu 5 Jahre erhalten. Der Pilz verfügt über ein breites Wirtsspektrum, weshalb er zweikeimblättrige Unkräuter und Zwischenfrüchte befallen und sich in diesen vermehren kann. Damit stellen Verticillium-infizierte Pflanzen, abgestorbene Pflanzenteile wie auch verseuchte Böden über lange Zeit eine ständige Infektionsquelle dar.
Der Pilz dringt über die Wurzel in die Pflanze ein und wächst bis in die Leitungsbahnen (Xylem) des Hopfens weiter. Dort bilden sich Sporen, die einen schnellen Weitertransport des Pilzes über die wasserleitenden Gefäße bis in die oberen Teile der Rebe und in die Blätter ermöglichen. Die Konidien wachsen zu Pilzgeflechten aus und verstopfen so die Wasserleitungsbahnen der Pflanze. Zusätzlich werden toxische, zellwandabbauende Enzyme vom Pilz ausgeschieden, die in der Pflanze Alterungsprozesse auslösen.
Ausbreitung von Verticillium in der Hopfenpflanze und im Boden (Zeichnung: Graf, 2016 abgeändert durch Euringer, 2018)
Schadbild
- Symptome ab Anfang Juni
- gescheckte Blätter, Blattnekrosen von unten nach oben
- Blattränder krümmen sich nach oben
- Braunverfärbung der Leitungsbahnen (Xylem)
- Verdickung der Rebenbasis
- Schlechtere Qualität der Dolden (Verbräunung)
- Absterben ganzer Triebe bzw. des Hopfenstocks
Schadbilder an Blättern und Reben nach Verticillium-Befall
Vorbeugende Bekämpfungsmaßnahmen
Es ist entscheidend, frühzeitig den Verticillium-Befall zu erkennen, um eine Verbreitung in und zwischen Hopfengärten gezielt zu vermeiden oder im besten Fall einen geringen Befall zu kurieren.
Vorbeugende Maßnahmen:
- Bodenverdichtungen vermeiden
- kein Ausbringen von frischem Rebenhäcksel (mind. 4 Wochen ablagern lassen mit regelmäßigem Wenden des Haufens)
- ausschließlich gesundes Pflanzmaterial mit Pflanzenpass verwenden
- keine Pflanzen aus infizierten Gärten vermehren
- angemessene Stickstoffdüngung
- Arbeitsgeräte sorgfältig reinigen
Bei beginnendem Befall:
- Nulltoleranz-Strategie: so früh wie möglich bekämpfen
- vollständiges Entfernen der infizierten Pflanzen (mit Wurzelwerk!) , sowie der direkten Nachbarpflanzen auch ohne Symptome kann eine Pflanze infiziert sein
- Befallenes Material von der Fläche entfernen
- Wiederaustrieb bekämpfen
- Düngung:
- reduzierte Stickstoffdüngung
- keinen Rebenhäcksel ausbringen
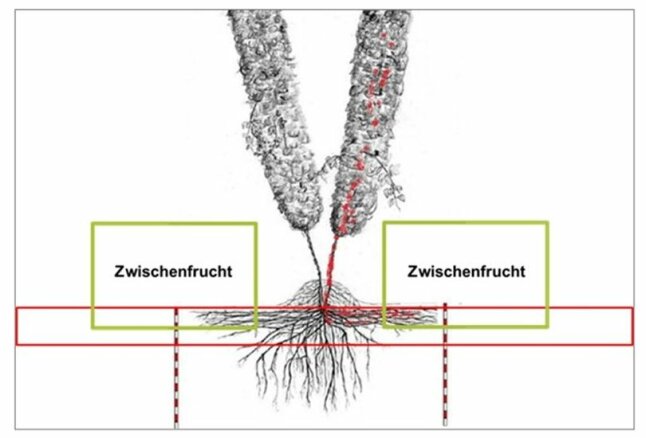
- Anbau neutraler Zwischenfrüchte (Gräser oder Getreide)
- kein erneutes Anpflanzen mit Hopfen
- Anbau einkeimblättriger Pflanzen (Getreide, Gräser)
- zweikeimblättrige Wirtspflanzen (Unkräuter) unterdrücken
- Feldhygiene beachten
- erst gesunde, dann befallene Gärten bearbeiten
- Desinfektion der Bearbeitungsgeräte (z.B. 4% MennoFlorades)
- Rebenhäcksel-Rückführung vermeiden
- infizierten Rebenhäcksel mindestens 4 Wochen einer ausreichend thermischen Behandlung (durchgehende Heißrotte mit Wenden des Haufens) unterziehen
- kein Fechsermaterial aus infizierten Hopfengärten entnehmen
Bei stärkerem Welke-Befall:
- Sanierung: Anbaupause von mind. 3 Jahren
- Ansaat einer Welke-neutralen Kultur (Gräser, Getreide, Mais)
- Unkraut bekämpfen: potentielle Welke-Wirtspflanzen
- Wiederaustrieb bekämpfen
- bei nesterweisem Auftreten im Hopfengarten einen Umgriff von einer Reihe links und rechts des Befallherdes und jeweils mind. 5 m in Längsrichtung roden
kein erneutes Anpflanzen mit Hopfen, sondern die gerodete Fläche mit einkeimblättrigen Pflanzen begrünen
- keine Erzeugung und Abgabe von Fechsermaterial im/aus dem Betrieb
- anschließende Bepflanzung mit toleranter Sorte
Bekämpfung
Bisher sind keine direkten Bekämpfungsmaßnahmen bekannt. Zur Befallsreduzierung werden die genannten, vorbeugenden Präventionsmaßnahmen empfohlen.
Um mehr Erfahrung bei der Bekämpfung von Verticillium zu sammeln, wird eng mit der Praxis zusammengearbeitet. Dabei werden Landwirte bei der Anwendung der Bekämpfungsmaßnahmen beraten, unterstützt und das Ergebnis evaluiert.

Rodung von Verticillium-infizierten Einzelstöcken mithilfe einer Staplergabel. Im Hintergrund Entfernen des infizierten Materials

Mit Spindelroder gerodeter Hopfengarten; anschließend müssen die Wurzelstöcke vom Feld entfernt und dann verbrannt werden.

Verticillium-infizierter Wurzelstock nach dem Entfernen aus dem Hopfengarten
Zielsetzung und Maßnahme
Ein wesentliches Ziel ist es, die Züchtung von Verticillium-toleranten Hopfensorten voranzutreiben. Um Zuchtstämme zu erkennen, die gegenüber milden und in besonderem Maße gegenüber aggressiven Verticillium-Stämmen Toleranzen aufweisen, wurde seit 2015 mit der Feldtestung in sogenannten „Selektionsgärten“ begonnen. In drei ehemaligen Praxisgärten, die mit aggressiven Verticillium-Stämmen verseucht sind, werden Hüller Zuchtstämme geprüft. Als Referenzsorten werden die Sorte Hallertauer Tradition (anfällig) und Herkules (tolerant) geführt.
Test von Hopfensorten und Stämmen auf Verticillium-Toleranz auf einer ehemaligen Praxisfläche mit sehr hohem Befallsdruck
Aktuelle Ergebnisse
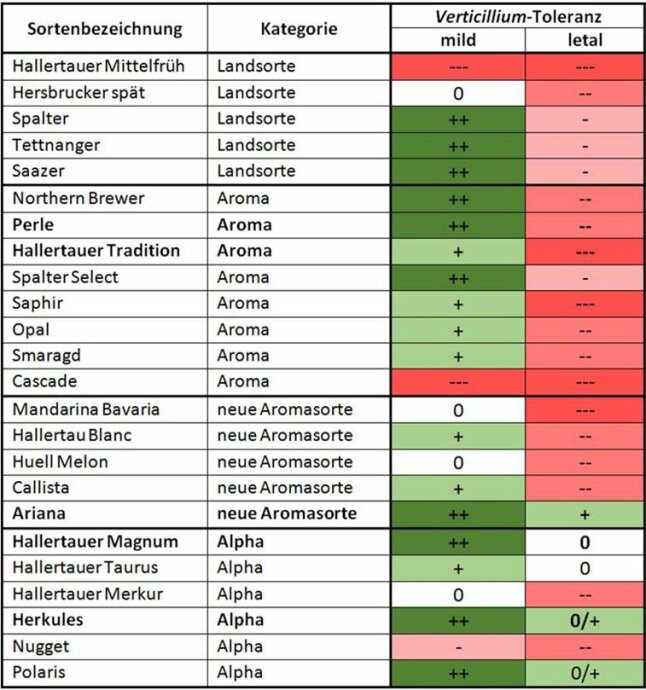
Toleranz der Sorten gegenüber Verticillium
Als passende Zeigerpflanze für die Hopfenwelke konnte die Aubergine (Solanum melongena L.) identifiziert werden, da sie auf diesen Erreger anfällig ist. Des Weiteren eignet sie sich für ein Topfsystem im Gewächshaus und entwickelt die typischen Welke-Symptome rasch. Mithilfe der Auberginen können aufgrund dessen beispielsweise mögliche Hygienisierungsmaßnahmen auf ihre Wirksamkeit gegenüber dem Verticillium-Pilz getestet werden.
Die Pflanzen werden im Topfsystem auf ihren Welke-Befall hin beobachtet. Bonitiert werden Parameter wie die Wuchshöhe, die Vitalität, sowie die Ausprägung der Welke-Symptome. Über die Entwicklung der Auberginen in den jeweiligen Varianten kann indirekt abgeleitet werden, ob sich in den Pflanztöpfen infektiöses Verticillium befindet und somit auch, ob die Hygienisierung erfolgreich war. Zusätzlich können ausgewählte Auberginen zur Absicherung der Ergebnisse labortechnisch untersucht werden (Dr. Seigner und Team IPZ 5c).
Thermische Hygienisierung von Rebenhäcksel
In diesem Versuch wurde die thermische Hygienisierung von Rebenhäcksel während einer vierwöchigen Haufen-Lagerung getestet. Dabei konnte festgestellt werden, dass das Infektionspotential des Verticillium-Pilzes durch eine vierwöchige Lagerung mit regelmäßigem Wenden der Rebenhäcksel gesenkt werden kann. Es muss jedoch unbedingt sichergestellt werden, dass die Erntereste regelmäßig gewendet werden, um ein Hygienisieren aller Schichten zu ermöglichen. Nur durch die hohen Temperaturen, die sich im Inneren des Rebenhäcksel-Haufens entwickeln, kommt es zu einem ausreichenden Abbau des Pilzes und somit zu einem deutlich geringeren Infektionspotentials des Rebenhäcksels.
Vergleich der Rebenhäcksel-Varianten nicht abgelagert (links) gegenüber 4-wöchiger Ablagerung (rechts) mit regelmäßigem Wenden der Rebenhäcksel-Schichten; Auswahl von repräsentativen Pflanzen aus jeder Variante
Zusammenfassung
Insgesamt lässt sich sagen, dass das Infektionspotential durch eine vierwöchige Haufenlagerung mit regelmäßigem Wenden des Rebenhäcksels deutlich gesenkt werden konnte. Thermisch behandelte Varianten schneiden besser ab als unbehandelte Varianten. Dies spricht für eine längere Lagerung bzw. Überlagerung des Materials, um so beim Ausbringen des Rebenhäcksels im Hopfengarten nicht zusätzlich den Infektionsdruck zu erhöhen. Dennoch empfiehlt es sich, Rebenhäcksel aus infizierten Beständen nicht wieder in die Hopfengärten zurückzubringen, da ein gewisses Rest-Infektionspotential bestehen bleibt.
Bodensanierung
Im Rahmen des Projekts Forschung zur Verticillium-Welke sollen praxistaugliche Methoden zur Sanierung von mit Verticillium befallen Hopfengärten erprobt und weiterentwickelt werden.
Vorgehensweise:
- Ausgangsbefall anhand der Symptome feststellen
- infizierten Bestand roden
- Sanierungsmaßnahmen durchführen:
- Stilllegung
- Anbau von Nicht-Wirtspflanzen
- Fruchtfolge mit hohem Gräser-/Getreideanteil
- Anbau von einkeimblättrigen Pflanzen
- Unkraut bekämpfen
- Nullkontrolle:
- Sanierungsfläche abgeschlossen sind
- Roden des infizierten Bestandes
- danach: Anbau einer toleranten Sorte
- Bewertungshorizont: mindestens 5 Jahre

Gegrubberte Teilfläche einer Hopfenanlage mit Welkebefall

Anbau von einkeimblättrigen Pflanzen (Getreide) zur Sanierung des Hopfengartens
Neben der Umsetzung von pflanzenbaulichen und phytosanitären Maßnahmen (siehe „Grünes Heft “) ist die Verwendung von Verticillium-freiem Pflanzmaterial ein entscheidender Baustein, um eine weitere Verbreitung des Verticillium-Pilzes im Hopfenanbaugebiet zu verhindern. Um Verticillium-freies Pflanzgut für die LfL-eigenen Prüfungen und für den Vertragsvermehrer der Gesellschaft für Hopfenforschung (GfH) sicherzustellen, werden Hopfenreben auf den Pilz hin untersucht. Eine hoch empfindliche Nachweismethode wurde dazu im LfL-Labor etabliert.
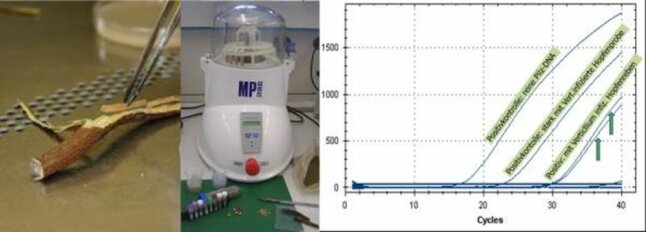
Ablauf des Verticillium-Nachweises von der Probennahme über die Homogenisierung des Rebenmaterials bis hin zum molekularen Nachweis über Realtime-PCR
Molekularer Nachweis direkt aus der Rebe über Realtime-PCR (Polymerasekettenreaktion) nach MAURER, RADIŠEK, BERG UND SEEFELDER (2013)
Von der zu untersuchenden Hopfenrebe wird ein Markstück herauspräpariert. Danach wird das Rebenstück in einem Homogenisator zerkleinert und für die Isolierung der DNA verwendet; Hopfen-DNA und auch DNA von möglichen Pilzkontaminationen in den Gefäßelementen werden mit isoliert. Mit der qPCR unter Einsatz, der für Verticillium spezifischen Primer und -Sonden zeigt sich letztlich der Pilzbefall durch einen Fluoreszenzanstieg zwischen Vermehrungszyklus 18 bis ca. 35.
Vorteile der Nachweismethode:
- sehr spezifisch
- ohne Verwechslungsgefahr mit anderen Pilzinfektionen
- simultaner Nachweis von Verticillium nonalfalfae und Verticillium dahliae in einem sogenannten Multiplex-PCR-Lauf. Des Weiteren wird dabei das Funktionieren der PCR-Reaktion stets durch eine sog. interne Kontrolle sichergestellt, um „falsch negative“ Ergebnisse auszuschließen
- Ergebnis liegt nach 2 Tagen vor
Nachteil der Nachweismethode:
- Nachweis beruht auf der vorhandenen DNA, die auch während des Verrottungsvorgangs noch nachweisbar sein kann
- keine klare Aussage, ob der Verticillium-Pilz noch infektiös wäre oder bereits abgestorben ist.
Verticillium, aber auch Viren können bei Hopfen zu dramatischen Ertrags- und Qualitätsausfällen führen. Doch mit Pflanzenschutzmitteln sind diese Krankheiten nicht zu bekämpfen. Umso wichtiger ist eine biotechnologische Methode, die sog. Meristemkultur, mit der es möglich ist, aus der Wachstumszone des Sprosses infizierter Hopfen nach einer Hitzetherapie gesunde, Virus- und Verticillium-freie Pflanzen zu regenerieren.
Methode
Zur Erzeugung von Verticillium-und Virus-freien Hopfenpflanzen wird die oberste Wachstumszone (= Meristem), die sich am Ende der Sprossspitze befindet, nach einer Hitzebehandlung herauspräpariert und auf Kulturmedium zum Wachsen gebracht. Aufgrund spezieller Nährstoffe im Gewebekulturmedium entstehen aus einem Meristem bereits nach etwa 3 Wochen Blattstrukturen, die sich weiter zu einer vollständigen Pflanze entwickeln.
Zur Absicherung des virusfreien Zustandes der aus den Meristemen sich entwickelnden Hopfen werden deren Blätter mit der DASELISA (Double Antibody Sandwich Enzyme Linked Immunosorbent Assay)-Technik bzw. mit der RT-PCR (Reverse Transkriptase Polymerasekettenreaktion) von der Arbeitsgruppe IPS 2c auf die verschiedenen hopfentypischen Viren untersucht.
Zur Bestätigung der über den Meristemschritt gelungenen Eliminierung des Verticillium-Pilzes werden die in vitro entstandenen Pflänzchen mit der qPCR unter Einsatz spezifischer TaqMan-Sonden und Primer auf Verticillium untersucht.

Aus der hitzebehandelten Sprossspitze wird das Meristem herauspräpariert; auf Kulturmedium entwickelt sich daraus ein Hopfenpflänzchen
Ergebnisse zur Optimierung der Meristemkultur
Der erste Schritt bei der Entwicklung des herausgeschnittenen Meristems mit der Bildung von kleinen Blättchen verläuft relativ zügig. Aber das weitere Wachstum und die Regeneration eines vollständigen Sprosses ist ein sehr zeitaufwändiger Prozess von bis zu 10 Monaten. Insbesondere weil die regenerierten Pflänzchen am Schluss nochmals verklont werden müssen, um genügend Ausgangsmaterial für die abschließenden Analysen zu haben, wobei ihr Verticillium- und Virus-freier Status verifiziert werden soll.
Um den gesamten Prozess deutlich zu beschleunigen, wurden verschiedene Parameter zur Kulturführung erforscht und optimiert. Insbesondere durch den Einsatz des sog. RITA®-Flüssigkultursystems wurde die Regeneration der Pflänzchen im Vergleich zur Kultivierung ausschließlich auf mit Agar verfestigtem Kulturmedium gravierend verkürzt. Es entstanden vitalere Pflanzen aus der Meristemkultur und zugleich konnte die Genotypen-Abhängigkeit der Regenerationsfähigkeit deutlich verbessert werden.

Regeneration des Meristems in vollständige Hopfenpfänzchen in Flüssigkultur bzw. auf Festmedium. Deutlich schnellere Entwicklung von schönen, vitalen Hopfen durch den Flüssigkulturschritt.


![]()