Institut für Pflanzenschutz
Jahresbericht 2021 – Virologie
 Zoombild vorhanden
Zoombild vorhanden
Indikatorpflanzentest: Pflanzenextrakt der virusverdächtigen Pflanze wird auf eine Testpflanze aufgetropft
Das virologische Labor der LfL – der Ansprechpartner für Virusdiagnose in Bayern
Viren sind mit die kleinsten Schaderreger, die an Pflanzen vorkommen. Sie bestehen lediglich aus Erbsubstanz (DNA oder RNA) und Eiweißen (Proteinen). Noch einfacher sind nur die Viroide aufgebaut, die pure RNA sind. Der Nachweis der Viren und Viroide ist schon allein aus diesem Grund schwierig und erfordert spezielle Techniken. Das virologische Labor der LfL ist in Bayern die zentrale Anlaufstelle, wenn es um die Diagnose von Viruskrankheiten geht. Auch Phytoplasmen, die zu den Bakterien zählen, werden im virologischen Labor der LfL bearbeitet. Unsere Untersuchungen zeigen, wo es in Bayern Probleme gibt, welche Viren, Viroide und Phytoplasmen gerade auftreten und ob ganz neue auftauchen.
Im Zuge der Globalisierung, des intensiven Handels mit Pflanzen und pflanzlichen Produkten und des Klimawandels besteht ein Risiko für die Einschleppung und Verbreitung von Viren. Oft werden nicht nur die Viren, sondern zugleich ihre tierischen Überträger (z. B. Thripse, Zikaden) eingeschleppt, die sich dann unter den immer milder werdenden Klimabedingungen hier ansiedeln können, auch wenn sie ursprünglich bei uns nicht heimisch waren.
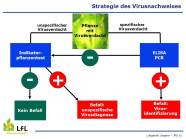
Auch im Jahr 2021 gab es bei den verschiedensten Kulturen Probleme mit Viren oder es wurden Viren als Auslöser der beobachteten Schäden vermutet. Nicht nur Pflanzenbauberater, Landwirtinnen und Landwirte sowie Gärtnerinnen und Gärtner, auch besorgte Hobbygärtner die auffällige Symptome an ihren Gewächsen feststellten, wandten sich an uns. So erreichten uns Proben aus den verschiedenen Bereichen: Zierpflanzen, Gemüse und Obstbau. Einen großen Teil unserer Tätigkeiten machten Diagnosen für den Hoheitsvollzug aus, z. B. für die Ausstellung von Pflanzengesundheitszeugnissen, die für den Export notwendig sind. Wir testen Pflanzen auf Quarantäneschädlinge und Schadorganismen, die aufgrund pflanzengesundheitlicher Vorschriften überwacht werden müssen, beispielsweise bei der Produktion von gesunden Mutterpflanzen. Zudem sind wir an Monitoringprogrammen beteiligt. Unsere Ergebnisse sind die Basis für gezielte Bekämpfungsmaßnahmen - eine Voraussetzung für hohe Erträge und hochwertige landwirtschaftliche und gärtnerische Produkte. So profitieren Produzenten, Verbraucher und Umwelt von unseren Arbeiten. Die Proben werden mittels ELISA und PCR-basierten Verfahren auf Viren, Viroide und Phytoplasmen untersucht. Ergänzend können biologische Testverfahren wie der Indikatorpflanzentest zum Einsatz kommen.
Virusdiagnose an der LfL
Ausgewähle Schlaglichter aus 2021
Tabak-Rattle-Virus an Pfingstrose

Typische Muster an einem Pfingstrosenblatt durch Tabak-Rattle-Virus
2021 wurden an Pfingstrosen markante Symptome wie ausgeprägte Blattzeichnungen und -aufhellungen beobachtet, die auf Virusbefall hindeuteten. Symptome an den Blüten wurden nicht festgestellt. Verschiedene Viren, die zum Teil noch nicht identifiziert sind, kamen als Auslöser in Betracht. Konkret an Pfingstrosen beschrieben sind das Tomatenbronzefleckenvirus (TSWV), Gurkenmosaikvirus (CMV) und Alfalfamosaikvirus (AMV), alles Viren die weit verbreitet sind und einen großen Wirtspflanzenkreis besitzen. In den uns vorgelegten Proben von Paeonia suffruticosa und Paeonia lactiflora haben wir das ebenfalls an Pfingstrose häufig vorkommende Tabak-Rattle-Virus (TRV, Tobacco rattle virus) gefunden. Das speziell an Pfingsrose, in der Fachsprache ‚Paeonia“ genannt, vorkommende TRV war früher unter den Bezeichnungen 'Peony ringspot virus' oder 'Peony mosaic virus' bekannt. Die Diagnose des TRV-Befalls ist schwierig, denn bestimmte Virusstämme lassen sich mit der laborüblichen Screeningmethode, dem ELISA, nicht detektieren. Wie eine Differenzialdiagnose mit ELISA und PCR zeigte, handelte es sich um den NM-Stamm des TRV, der nur mittels RT-PCR, nicht aber mit dem ELISA nachgewiesen werden konnte. Der NM-Stamm ist im Gegensatz zum M-Stamm nicht durch Nematoden und nur sehr schwer mechanisch übertragbar.
Wie gelangt TRV in einen Bestand und wie verbreitet es sich?
TRV kann durch den Erwerb infizierter Pflanzen eingeschleppt werden. Oft werden infizierte Pflanzen als solche nicht erkannt. Werden infizierte Mutterpflanzen durch Teilung des Wurzelstocks vermehrt, so sind alle Abkömmlinge ebenfalls infiziert. Sind bestimmte Nematoden im Boden vorhanden und liegt der M-Stamm des TRV vor, so kann das Virus über die Nematoden von Pflanze zu Pflanze gelangen. Der M-Stamm ist zudem mechanisch übertragbar, z. B. über verseuchte Werkzeuge. Aus dem ursprünglichen M-Stamm kann der NM-Stamm entstehen, der dann nicht mehr durch Nematoden übertragen wird und für den das Risiko der mechanischen Übertragung gering ist. Ausgangspunkt für die TRV-Infektion können auch andere Wirtspflanzen sein: landwirtschaftliche Kulturen wie Kartoffeln, Leguminosen, Raps, aber auch Zierpflanzen (beispielsweise Narzissen, Hyazinthen, Gladiolen, Tulpen) und Gemüse (wie Gurke, Paprika, Salat, Möhren) können Wirtspflanzen sein. Mehrjährige Unkräuter spielen bei der Überdauerung des Virus eine entscheidende Rolle – auch eine Verbreitung über Samen ist möglich.
Weitere Informationen zum Tabak-Rattle-Virus
Lily mottle virus an Lilie
 Zoombild vorhanden
Zoombild vorhanden
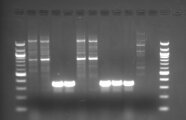
Bandenmuster auf einem Elektrophoresegel: Nachweis von Potyviren in den Spuren 4 und 5 sowie 8, 9 und 10.
An unterschiedlichen Lilien-Sorten wurde das Lilienscheckungsvirus, auch Lily mottle virus (LMoV) genannt, gefunden. Beobachtet wurde verzwergter Wuchs in Kombination mit einer reduzierten Anzahl an Blütenknospen. Auffällig war der lückenhafte Bestand und es resultierte annähernd Totalausfall. Das LMoV gehört zu den weit verbreiteten und häufig vorkommenden Potyviren und wird durch Blattläuse übertragen. Der Nachweis erfolgte mittels RT-PCR mit Potyvirus-spezifischen Primern. Die RT-PCR-Produkte wurden anschließend in einem Sequenzierlabor sequenziert. Über einen Vergleich der gewonnenen genetischen Sequenz mit bekannten Virussequenzen wurde das vorliegende Virus als Lily mottle virus identifiziert. Bemerkenswert ist, das LMoV nicht in allen auffälligen Pflanzen gefunden wurde. Das Lily symptomless carlavirus (LSV), das häufig in Kombination mit LMoV vorkommt, wurde in den eingesandten Proben nicht nachgewiesen.
Symptome und Übertagung des LMoV
 Zoombild vorhanden
Zoombild vorhanden
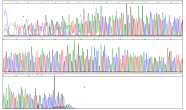
Chromatogramm der LMoV-Sequenzierung: 4 verschiedene Farben stehen für 4 verschiedene Basen (= Bausteine der DNA). Die Abfolge der Farben (= Basen) entspricht der genetischen Sequenz.
Die Ausprägung der Symptome ist Sorten-abhängig. Neben Stauche und verringerter Knospenzahl können Adernaufhellungen, Blattscheckungen, Mosaik, Blattchlorosen, gelben Streifen, Blattverdrehungen sowie Nekrosen auftreten. Auch Blütenfarbe und -form können beeinflusst sein. Die Knollen fallen möglcherweise kleiner aus. Die Ausbildung von Symptomen kann auch unterbleiben (latenter Befall). Für Vermarkter und Blumenliebhaber ist entscheidend, dass LMoV auch die Blüten- und Schnittblumenqualität mindert. Mischinfektionen mit dem Lily symptomless carlavirus (LSV) führen zur Symptomverstärkung (Quellen: www.plantwise.org; Zhang et al., 2016). LMoV wird nicht-persistent durch bestimmte Blattläuse wie Myzus persicae, Macrosiphum euphorbiae und Aphis fabae übertragen (Ortego et al. 2004), dabei reichen schon kurze Probestiche für eine Virusabgabe an die Pflanze aus.
Untersuchungen von Hopfen auf CBCVd und HpSVd
 Zoombild vorhanden
Zoombild vorhanden
Freisetzung von Fluoreszenzstrahlung bei der CBCVd-Untersuchung mittels Realtime RT-PCR: Kurven einer Verdünnungsreihe. Je höher die Verdünnung, d.h. je geringer die CBCVd-Konzentration, desto später der Anstieg der freigesetzten Fluoreszenzstrahlung
Unter Federführung der Arbeitsgruppe Pflanzenschutz Hopfen des Instituts für Pflanzenbau und Pflanzenzüchtung der LfL wurde an über 400 Proben ein Monitoring auf das gefürchtete Citrus bark cracking viroid (CBCVd) an Hopfen durchgeführt. Im Rahmen eines sogenannten Freiwilligen-Monitorings konnten sich Hopfenpflanzer melden und ihre Proben zusätzlich auf das Hopfenstaucheviroid (Hop stunt viroid, HpSVd) testen lassen. Die CBCVd-Untersuchungen mittels Realtime RT-PCR (Seigner et al. 2020) wurden von der LfL an ein externes Diagnoselabor vergeben, die Methodik wurde vom virologischen Labor der LfL detailliert vorgegeben. Die Auswertung der Realtime RT-PCR-Tests des externen Labors sowie alle Bestätigungstests, die in gewissem Umfang zur Qualitätssicherung an positiven und negativen Proben durchgeführt wurden, erfolgten im virologischen Labor der LfL. Die Untersuchungen mittels Realtime RT-PCR auf HpSVd (Luigi & Faggioli 2013) fanden ausschließlich an der LfL statt. Auch Untersuchungen von Hopfenvermehrungsmaterial auf CBCVd wurden durchgeführt. Pro begonnenen Hektar wurde i.d.R. 30 Hopfenpflanzen beprobt und jeweils 1 Blatt der zu untersuchenden Pflanze abgenommen. 10 Blätter von 10 Pflanzen wurden als Sammelprobe auf CBCVd untersucht, so dass pro begonnenen Hektar 3 Sammelproben analysiert wurden. Als Nachweismethode kam wiederum Realtime RT-PCR zur Anwendung. Die Untersuchungen des Hopfenvermehrungsmaterials fanden ausschließlich im virologischen Labor der LfL statt.
Verzwergungsvirusmonitoring im Ausfallgetreide
Auch im Herbst 2021 wurde in enger Kooperation mit den Ämtern für Ernährung, Landwirtschaft und Forsten (ÄELF) ein Monitoring auf Verzwergungsviren im Ausfallgetreide durchgeführt. Damit konnte den Landwirten ein Überblick über die aktuelle Befallssituation gegeben werden. Auch das Risiko für Infektionen in den später auflaufenden jungen Beständen und die Notwendigkeit etwaiger Bekämpfungsmaßnahmen konnte so besser abgeschätzt werden - dennoch: Kontrollen des eigenen Bestandes sind für jeden Landwirt unerlässlich. Der Anteil Verzwergungsviren-infizierter Pflanzen im Herbst 2021 betrug insgesamt ca. 21 % und lag damit unter dem Niveau der Jahre 2017 bis 2020 (2020: 25 % infizierte Pflanzen, 2019: 37 %, 2018: 40 %; 2017: 25 %). Bei gut 19 % der Proben wurde BYDV/CYDV-Befall nachgewiesen (2020 und 2019: 10 %, 2017 und 2018: 4 %). Der Anteil BYDV/CYDV-infizierter Pflanzen war damit höher als in den Vorjahren, erreichte aber nicht das Niveau der Befallsjahre 2007 (79 %) und 2016 (40 %). Nur etwas über 2 % der Proben waren WDV/BDV-positiv. Der Anteil WDV/BDV-infizierter Proben war damit gegenüber den Vorjahren deutlich rückläufig (2020: ca. 19 %, 2019: 33 %, 2018: 37 %, 2017: 22 %).
Lesen Sie über die diesjährigen Ergebnisse und werfen Sie einen Blick zurück
Qualitätssicherung und Akkreditierung
Im Jahr 2021 haben wir unser Methodenspektrum weiter verbreitert und Verfahren für den Nachweis von Viren und Viroiden etabliert, validiert und für die sichere Routinediagnose optimiert. Damit konnten wir auch die flexible Akkreditierung von Nachweismethoden nach der international geltenden Norm DIN EN ISO/IEC 17025 ausbauen. Im Fokus standen dabei Realtime RT-PCR und konventionelle RT-PCR zum Nachweis verschiedener Hopfenviren und -viroide, insbesondere des Citrus bark bracking viroids und des Hop stunt viroids (Hopfenstauche-Viroid). Zudem führten wir umfangreiche Validierungsversuche für den Nachweis des Tomato brown rugose fruit virus ("Jordanvirus") mittels Realtime RT-PCR und konventioneller RT-PCR durch. Zur Überprüfung unserer Kompetenz haben wir 2021 an zwei Laborvergleichsuntersuchung zum Nachweis des Jordanvirus an Blattmaterial bzw. Saatgut teilgenommen, eine fand auf nationaler Ebene, die andere auf internationaler Ebene statt. Zur Anwendung kamen dabei Realtime RT-PCR, konventionelle RT-PCR und ELISA. Ende September 2021 wurden die Diagnoselabore der LfL wieder einer umfänglichen System- und Fachbegutachtung durch die DAkkS (Deutsche Akkreditierungsstelle) unterzogen. Mit der Akkreditierung belegt ein Diagnoselabor seine Kompetenz, Analysen kontinuierlich richtig durchzuführen. Die Bestätigung dieser Kompetenz erfolgt durch die DAkkS, als unabhängige Einrichtung. Maßgeblich für eine Akkreditierung in diesem Bereich der Laboranalytik ist die international anerkannte Norm DIN EN ISO 17025 "Allgemeine Anforderungen an die Kompetenz von Prüf- und Kalibrierlaboratorien".
 Zoombild vorhanden
Zoombild vorhanden
 Zoombild vorhanden
Zoombild vorhanden

 Zoombild vorhanden
Zoombild vorhanden
 Zoombild vorhanden
Zoombild vorhanden
 Zoombild vorhanden
Zoombild vorhanden
 Zoombild vorhanden
Zoombild vorhanden
 826 KB
826 KB



