
Neuer Ansatz zur Erfassung von Kartoffelviren an dormanten Kartoffelknollen via Loop-Mediated Isothermal Amplification (LAMP)
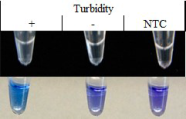
Farbumschlag der LAMP: Positiv (+); Negativ (-); Wasserkontrolle (NTC)
Virusprüfung anhand des ELISA-Verfahrens
Die LfL verwendet zur Virusdetektion standardmäßig das bewährte serologische Enzyme-linked Immunosorbent Assay (ELISA) Verfahren an Knollendunkelkeimen (Gugerli, 1979; Gugerli and Gehriger, 1980). Um jedoch mit dieser Methode verlässlich Viren in Kartoffelknollen erfassen zu können, muss eine vier- bis sechswöchige Virusanreicherungsphase dem Test vorausgehen. Dabei wird die Keimruhe der Kartoffelknollen gebrochen, sodass Knollendunkelkeime auswachsen können in denen sich das Virus vermehren kann. Die lange Zeitspanne zwischen Probenahme und Testergebnis hat sich jedoch für viele Anbauer als wirtschaftlich problematisch erwiesen.
Es sind bereits zahlreiche alternative Methoden für die Kartoffelvirusdetektion entwickelt worden, die sich auch für dormante Kartoffelknollen eignen; u. a. die Hybridisierung mit Dioxigenin gelabelten RNA Molekülen (Singh and Singh, 1995; Verma et al. 2003), die klassische Revervese Transcriptase Polymerase Chain Reaction (RT-PCR; Barker et al., 1993; Singh and Singh, 1996; Nie and Singh, 2000; usw.) und auch verschiedene Modifikationen davon (z.B. Immunocapture-RT-PCR; Ahouee et al. 2010; Gawande et al. 2011). Die Real-Time Reverse Transcriptase quantitative Polymerase Chain Reaction (RT-qPCR; Boonham et al. 2009, Agindotan et al. 2007) bietet allerdings bis jetzt den sensitivsten Ansatz zur Virusdetektion. Jedoch setzt diese Methode einen enormen kostenintensiven apparativen und materiellen Aufwand voraus (Anschaffung eines Real-Time PCR Thermocyclers und hohe Kosten für Real-Time Reagenzien).
Um den Virusnachweis schneller als mit ELISA jedoch ähnlich kostengünstig durchführen zu können, wird in Zusammenarbeit mit dem Fachgebiet Obstbau der TU München an Alternativen zur Detektion von Kartoffelviren an der keimruhigen Kartoffelknolle geforscht.
Das Loop Mediated Isothermal Amplification Verfahren
Vielversprechend ist die Reverse Transkriptase Loop-Mediated Isothermal Amplification (RT-LAMP, Notomi et al. 2000). Diese Nucleinsäure-basierte und isothermale Methode wurde im Fachgebiet Obstbau schon erfolgreich bei der Scharkavirendetektion an Steinobst etabliert (Hadersdorfer et al. 2011).
 Zoombild vorhanden
Zoombild vorhanden
Abb. 1:
Schema der LAMP Reaktion
Dabei wird in einem Ansatz die einzelsträngige RNA der zu testenden Kartoffelviren mittels des Enzyms Reverse Transkriptase ausgehend von spezifischen Primern in DNA umgeschrieben und anschließend amplifiziert. Zur Amplifikation dient hierbei die DNA Polymerase, die eine hohe Strangverdrängungsaktivität besitzt, wodurch in Kombination mit speziell designten Primern auf die thermische Denaturierung verzichtet werden kann. Somit können anstatt teurer Thermocycler einfache Heizblöcke zur Amplifikation verwendet werden. Ein LAMP-Primerset besteht aus mindestens vier Primern (F3, FIP, B3, BIP), die an sechs spezifischen Regionen der Zielsequenz binden. F3 und B3 begrenzen dabei die Zielsequenz als vorwärtsgerichtete und rückwärtsgerichtete Primer, vergleichbar mit Primern der PCR. FIP und BIP bestehen am 3ˈ-Ende aus einer homologen Sequenz (B1c und F1c) und am 5ˈ-Ende aus einer komplementären Sequenz (B2 und F2) zur Zielsequenz. Sie binden innerhalb der von F3 und B3 begrenzten Region.
Die DNA Polymerase, die die Stränge ausgehend von F3 und B3 Primern amplifiziert, schiebt jeweils die durch die FIP und BIP Primer initiierten Stränge ab. Daraus ergibt sich ein hantelförmiges Ausgangsmolekül. Dieses wird mit Hilfe der speziellen DNA Polymerase und den Primern FIP und BIP verlängert und fortlaufend vervielfältigt (siehe Abbildung 1). Die Sensitivität der LAMP ist vergleichbar mit PCR-basierten Methoden, je nach Primerset und Optimierung kann diese höher ausfallen.
Die DNA Polymerase, die die Stränge ausgehend von F3 und B3 Primern amplifiziert, schiebt jeweils die durch die FIP und BIP Primer initiierten Stränge ab. Daraus ergibt sich ein hantelförmiges Ausgangsmolekül. Dieses wird mit Hilfe der speziellen DNA Polymerase und den Primern FIP und BIP verlängert und fortlaufend vervielfältigt (siehe Abbildung 1). Die Sensitivität der LAMP ist vergleichbar mit PCR-basierten Methoden, je nach Primerset und Optimierung kann diese höher ausfallen.
Möglickkeiten der Visualisierung positiver Proben
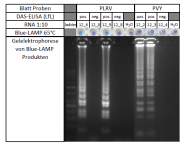 Zoombild vorhanden
Zoombild vorhanden
Abb.2:
RNA aus Blattproben wurde amplifiziert mittels LAMP
Die hohe Amplifikationsrate der LAMP erlaubt andere Möglichkeiten der Visualisierung als die anschließende Gelelektrophorese, die bei einer klassischen PCR üblicherweise angewendet wird. Die Amplifikation von Virus RNA kann indirekt über die Anreicherung von Pyrophosphat-Magnesium-Komplexen festgestellt werden. Pyrophosphat entsteht durch den Einbau von Desoxynukleotidtriphosphaten bei der DNA Synthese als Nebenprodukt und komplexiert die im Reaktionsansatz frei verfügbaren Magnesium-Ionen. Dies wird als weißliche Trübung mit dem bloßen Auge sichtbar. Bei Zugabe des Metallionenindikators Hydroxynaphtolblau (HNB), entsteht ein deutlich sichtbarer Farbumschlag von lila nach blau. Dies zeigt eine sinkende Konzentration von frei verfügbaren Magnesium Ionen an und geht mit der Zunahme von Pyrophosphat-Magnesium-Komplexen einher (Goto et al. 2009; Hadersdorfer et al. 2011; Blue-LAMP; siehe Abbildung 2).
Ausblick
Für PVY und PLRV konnten mittlerweile mehrere Primersets designed und getestet werden. Um jedoch die LAMP-Methode als neue Standardmethode in der Virustestung erfolgreich einsetzen zu können, muss das Verfahren auf die Kartoffelviren weiter optimiert werden. Außerdem ist es äußerst wichtig die derzeitigen Standardverfahren (ELISA, RT-PCR und RT-qPCR) mit dem LAMP Nachweis zu vergleichen, um die Sensitivität des Nachweises einordnen zu können. Des Weiteren wird an einer vereinfachten Probenaufbereitung von dormanten Kartoffelknollen gearbeitet. Hier hat die LAMP großes Potential, da die spezielle DNA Polymerase mit der Strangverdrängungsaktivität auch in Gegenwart von Inhibitoren (z.B. Polysaccharide) erfolgreich arbeiteten kann. Die LAMP als isothermale Methode zum amplifizieren von Erbgut lässt eine Anwendung auch in einfach ausgestatten Laboratorien zu und gewinnt deshalb zunehmend an Bedeutung.
Literatur
- Agindotan, B. O., Shiel, P. J. and Berger, P. H. (2007): Simultaneous detection of potato viruses, PLRV, PVS, PVX and PVY from dormant potato tubers by TaqMan realtime RT-PCR. Journal of Virological Methods 142: 1–9
- Barker, H., Webster, K. D. and Reavy, B. (1993): Detection of potato virus Y in potato tubers: a comparison of polymerase chain reaction and enzyme-linked immunosorbent assay Potato Research 36 (1993) 13- 20
- Boonham, N., Laurenson, L., Weekes, R. and Mumford, R. (2009): Direct detection of plant viruses in potato tubers using real-time PCR. Methods in Molecular Biology, Plant Pathology 508: 249-258
- Gawande, S. J., Shukla, A., Chimote, V. P., Kaushal, N., Kaundal, P., Garg, I. D. and Chimote, K. P. (2011): Development of PCR-based techniques for the detection of immobilized Potato Virus Y Viroins. Journal of Plant Pathology 93 (1): 127-132
- Goto, M., Honda, E., Ogura, A., Nomoto, A. and Hanaki, K.-I. (2009): Colorimetric detection of loop-mediated isothermal amplification reaction by using hydroxynaphthol blue. Biotechniques 46: 167–172
- Gugerli, P. (1979): Le test immuno-enzymatique (ELISA) et son applicationpour le diagnostic rapide de viroses de la pomme de terre. Revue Suisse Agricole 11: 253–260
- Gugerli, P. and Gehriger, W. (1980): Enzyme-linked immunosorbent assay (ELISA) for the detection of potato leafroll virus and potato virus Y in potato tubers after artificial break of dormancy. Potato Research 23: 353-359
- Hadersdorfer, J., Neumüller, M., Treutter, D. and Fischer, T. C. (2011): Fast and reliable detection of Plum pox virus in woody host plants using the Blue LAMP protocol. Annals of Applied Biology 159: 456–466
- Ahouee, H. Kh., Habibi, K. M. and Mosahebi, G. H. (2010): A Detection of potato leafroll virus isolated from potato fields in Tehran province in aphids by immunocapture reverse transcription polymerase chain reaction. African Journal of Biotechnology Vol. 9 (16): 2349-2352
- Notomi, T., Okayama, H., Masubuchi, H., Yonekawa, T., Watanabe, K., Amino, N. and Hase, T. (2000): Loop-mediated isothermal amplification of DNA. Nucleic Acids Research 28: e63
- Singh, M. and Singh, R. P. (1996): Factors affecting detection of PVY in dormant tubers by reverse transcription polymerase chain reaction and nucleic acid spothybridization. Journal of Virological Methods 60: 47-57
- Singh, R. P., Nie, X. and Singh, M. (2000). Duplex RT-PCR: reagent concentrations at reverse transcription stage affect the PCR performance. Journal of Virological Methods 86: 121-129
- Struik, P. C. and Wiersema, S. G. (1999): Seed potato technology. Hrsg. Wageningen Academic Publishers pp. 129
- Union der Deutschen Kartoffelwirtschaft e. V. (2011): Unika Bericht 2011. Hrsg. Unika, Berlin pp. 38


