Nanoviren - eine neue Gefahr für den Leguminosen-Anbau
Befall mit den neu auftretenden Nanoviren kann den Leguminosenanbau ernsthaft gefährden. Die wirtschaftlichen Schäden können erheblich sein, im Extremfall kann es zu Totalausfall der Ernte kommen. Insbesondere Ökobetriebe sind betroffen, da hier keine wirksamen Pflanzenschutzmittel oder Verfahren zur Bekämpfung der virusübertragenden Blattläuse zur Verfügung stehen. Resistente Sorten gibt es derzeit nicht.
In der Vergangenheit dominierten andere Viren, wenn es um Virusbefall an Leguminosen ging, z. B. das Scharfe Adernmosaik-Virus (= Erbsen-Enationenmosaik-Virus, Pea enation mosaic virus), das Alfalfamosaik-Virus, das Bohnenblattrollvirus, bestimmte Mosaikviren und andere Viren verschiedener taxonomischer Gruppen. Diese Viren führen zwar zu Ertragseinbußen, aber nicht zu Totalverlusten.
2016 wurde zum ersten Mal in vielen Regionen Deutschlands starker neuartiger Virusbefall festgestellt. Der Großteil der infizierten Pflanzen war mit dem Scharfen Adernmosaik-Virus (Pea enation mosaic virus) infiziert; aber ein ebenfalls beträchtlicher Anteil der Infektionen wurde auf einen zunächst unbekannten Erreger zurückgeführt (Gaafar et al 2016). Dr. Heiko Ziebell, Virologe am Julius Kühn-Institut (JKI) in Braunschweig, fand die Ursache: Die Schäden wurden von sogenannten Nanoviren hervorgerufen. Bisher wurde in Deutschland lediglich ein Vertreter der Nanoviren gefunden, das Pea necrotic yellow dwarf virus (PNYDV, Nekrotisches Erbsengelbverzwergungsvirus).
Das flächenmäßige Auftreten der Nanoviren ist besonders problematisch, da der Leguminosenanbau in Deutschland und Bayern zunehmend an Bedeutung gewinnt. Mit dem Ziel des Klimaschutzes und der Förderung der Artenvielfalt startete das Bundesministerium für Ernährung und Landwirtschaft (BEML) 2012 die Eiweißpflanzenstrategie. Das Bayerische Staatsministerium für Ernährung, Landwirtschaft und Forsten (StMELF) gab bereits im März 2011 den Startschuss für die "Bayerische Eiweißstrategie", um den Leguminosenanbau nachhaltig zu fördern und den Import von Eiweißfuttermitteln zu reduzieren. Durch den Einsatz von Eiweißfuttermitteln aus heimischer Produktion kann auf gentechnisch veränderte Soja als Futtermittel verzichtet werden.
Was sind Nanoviren?
Die Vorsilbe "Nano" leitet sich von der griechischen Bezeichnung für "Zwerg" ab. Der Name ist hier Programm: Nanoviren sind äußerst klein - es handelt sich um die bislang kleinsten bekannten Viren mit einem Durchmesser ca. 20 nm (= 20 x 10-9 m). Zudem verursachen Nanoviren eine typische Verzwergung der Pflanzen. In infizierten Pflanzen kommen die Nanoviren nur in den Nährstoffleitbahnen (Phloem) der Leitbündel vor. Sie infizieren ausschließlich Leguminosen.
Aufbau der Nanoviren
Ein Viruspartikel besteht aus einem Capsid (Mantel), welches aus Proteinen (Eiweißen) besteht. Das Capsid besitzt die Form eines Ikosaeders (symmetrisch aufgebauter Zwanzigflächner): Im Inneren befindet sich das genetische Material (Genom) des Virus. Das Genom der Nanoviren besteht aus 6 bis 8 separaten Komponenten (vielteiliges = "multipartites" Genom) und ist entsprechend auf 6 bis 8 einzelne Viruspartikel verteilt. Jede Genomkomponente besteht aus einem einzelnen zirkulären DNA-Einstrang, der für jeweils nur 1 Gen steht. Jedes Gene trägt die Information für 1 bestimmtes Protein, z. B. Capsid-Protein, Protein für die Vermehrung, Protein für den Transport innerhalb der Pflanze usw.
Nanovirus-Diversität
Bisher wurde in Deutschland nur das Pea necrotic yellow dwarf virus (PNYDV, Nekrotisches Erbsenverzwergungsvirus; Grigoras et al. 2010) nachgewiesen (Ziebell, persönliche Mitteilung). Es gibt jedoch eine Reihe anderer, verschiedener Nanovirus-Arten.
Bisher identifizierte Nanoviren
- Pea necrotic yellow dwarf virus (PNYDV, Nekrotisches Erbsenverzwergungsvirus; Grigoras et al. 2010)
- Subterranean clover stunt virus (SCSV, Subterranes Kleestauche-Virus; Chu & Helms 1988)
- Faba bean necrotic yellows virus (FBNYV, Nekrotisches Fababohnenvergilbungsvirus; Katul et al.1997, 1998)
- Milk vetch dwarf virus (MDV, Tragantverzwergungsvirus; Sano et al. 1998)
- Faba bean necrotic stunt virus (FBNSV, Nekrotisches Fababohnenstauche-Virus, Grigoras et al. 2009)
- Faba bean yellow leaf virus (FBYLV, Fababohnengelbblatt-Virus; Abraham et al. 2012)
- Black medic leaf roll virus (BMLRV, Hopfenkleeblattroll-Virus; Grigoras et al. 2014)
- Pea yellow stunt virus (PYSV, Erbsengelbstauche-Virus; Grigoras et al. 2014)
Die Viren sind miteinander verwandt, die genetische Diversität ist jedoch aufgrund häufiger Mutationen und des Umbaus von genetischem Material (genetische Rekombination) recht groß (Grigoras et al. 2010 und 2014).
Vorkommen
Nanoviren traten früher nur in wärmeren Gebieten wie in Nord- und Ostafrika, im Nahen Osten und in Asien an verschiedenen Leguminosen auf. Mit dem Faba bean necrotic yellows virus (FBNYV) wurde 2000 erstmals ein Nanovirus in Europa (Spanien) gefunden (Babin et al. 2000). 2009 wurde das Pea necrotic yellow dwarf virus (PNYDV) zum ersten Mal in Deutschland in Sachsen-Anhalt an Erbse durch das JKI nachgewiesen. Von da an wurde PNYDV in verschiedenen Bundesländern und auch im Ausland immer wieder beobachtet. In den Folgejahren waren auch Schweden, Ungarn, in besonderem Maße Österreich sowie Serbien betroffen; vor allem Ökobestände zeigten Befall (Ziebell und Friedrich 2014). 2016 kam es zum ersten Mal zu einem nahezu deutschlandweiten Befall.
Welche Kulturen sind betroffen?
Nanoviren infizieren ausschließlich Leguminosen. Dabei können eine ganze Reihe verschiedener Leguminosenarten befallen werden. Als gefährdet sind all diejenigen Kulturen einzustufen, an denen bereits Befall beobachtet wurde. Die Liste mit anfälligen Kulturen gilt als vorläufig und kann noch länger werden. Die folgende Aufzählung beruht auf Angaben und Publikationen verschiedener Wissenschaftler (Ziebell, JKI, persönliche Mitteilung; Grigoras et al. 2010, Ziebell und Friedrich 2014, Gaafar et al. 2016).
- Erbse (Gemüse- und Futtererbse, Pisum sativum,)
- Ackerbohne (Vicia faba)
- Bestimmte Wicken wie Futterwicke (Vicia sativa) und Pannonische Wicke (= Ungarische Wicke, Vicia pannonica)
- Linse (Lens culinaris)
- Platterbse (Lathyrus sativa)
- Kichererbse (Cicer arietinum)
- Bestimmte Kleearten wie Hopfenklee (Medicago lupulina) und Inkarnatklee (Trifolium incarnatum)
Kulturen ohne Nanovirus-Befall
Als nicht befallen gelten derzeit z.B.
- Sojabohne (Glycine max), die an Bedeutung stark zunimmt
- Bohne (Phasaeolus vulgaris)
- Rot-/Wiesenklee (Trifolium pratense)
- Weißklee (Trifolium repens), Weiße und Blaue Lupine (Lupinus albus und Lupinus angustifolius)
- Luzerne (Medicago sativa)
Ein Befall ist aber auch an diesen Kulturen nicht gänzlich auszuschließen (Quelle: Ziebell, JKI). Hier gilt es auf verdächtige Symptome zu achten und im Zweifelsfall Laboruntersuchungen durchführen zu lassen.
Symptome und Übertragung
Symptome
Auffällig ist das zunächst nesterweise, starke Vergilben und die Verzwergung der Pflanzen. Teile der Pflanze sterben ab, schließlich stirbt die gesamte Pflanze. Der Befall breitet sich mit den Blattläusen im Bestand aus. Am Ende steht ein möglicher Totalausfall der Ernte.
Übertragung
Nanoviren werden weder mechanisch übertragen noch über Samen. Die Übertragung erfolgt nur durch wenige Blattlausarten. Die Saugzeit, in der Viren von der Blattlaus aufgenommen werden, beträgt einige Stunden bis Tage. Die Viren gelangen zunächst in den Blattlausdarm und zirkulieren danach in der Körperflüssigkeit (Hämolymphe) der Blattläuse. Die Viren werden dann während erneuten Saugens an die Wirtspflanze abgegeben und die Pflanze dadurch infiziert. Die Blattlaus bleibt mindestens einige Tage oder auch zeitlebens infektiös. Der wichtigste Überträger ist die Grüne Erbsenblattlaus (Acyrthosiphon pisum) (Ziebell und Friedrich, 2014); weniger bedeutsam sind die Schwarze Bohnenlaus (Aphis fabae) und die Kuhbohnenlaus (Aphis craccivora). Forschungsarbeiten zu weiteren möglicherweise Nanoviren-übertragenden Blattlausarten laufen.
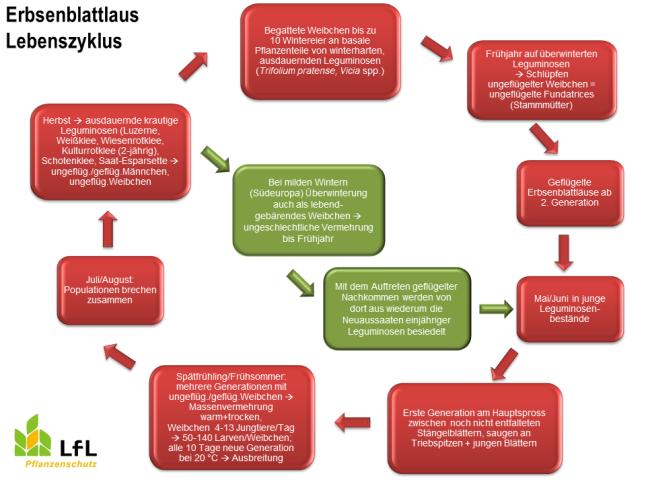
Die Grüne Erbsenblattlaus besiedelt ausschließlich Leguminosen, ist also eine nicht wirtswechselnde Art. Aus den Eiern, welche im Winter auf winterharten, ausdauernden Leguminosen abgelegt worden waren, schlüpfen im Frühjahr ungeflügelte Weibchen, welche die Stammmütter (Fundatrices) für die Folgegenerationen sind. Folgegenerationen entstehen auf ungeschlechtlichem Wege, werden also lebend geboren. Bereits ab der zweiten Generation schlüpfen geflügelte Weibchen, die in die jungen Leguminosenbestände einfliegen. Danach entwickeln sich die weiteren Generationen - unter optimalen, warmen trockenen Witterungsbedingungen kommt es zu einer Massenvermehrung; es erscheinen ungeflügelte und geflügelte Weibchen. Im Hochsommer brechen die Populationen zusammen. Im Herbst fliegen die Blattläuse auf ausdauernde krautige Leguminosen; ungeflügelte und geflügelte Männchen sowie ungeflügelte Weibchen entstehen. Begattete Weibchen legen Wintereier an basale Pflanzenteile von den Winter überdauernden Leguminosen. Milde Winter überstehen auch lebendgebärende Weibchen und es kommt zu einer ungeschlechtlichen Vermehrung bis zum Frühjahr. (Quelle: Hoffmann & Schmutterer, 1983)
Gründe für das verstärkte Befallsaufkommen
Das 2016 beobachtete, überraschend massive Auftreten von Nanoviren bzw. der häufige Nachweis von Nanoviren warf die Frage nach dem "Warum" auf. Das Zusammenspiel verschiedener Faktoren ist hier höchst wahrscheinlich ausschlaggebend:
- Ausweitung der Leguminosenanbaufläche: Laut Angaben des Bundesministeriums für Ernährung und Landwirtschaft (BMEL) kam es im Zeitraum von 2012 bis 2016 zu mehr als einer Verdoppelung der Anbaufläche. Der Anbau von Ackerbohnen, Lupinen und Erbsen hat seit 2014 um 75 % auf bundesdeutschen Äckern zugenommen. Die Sojabohnenfläche hat sich seit 2012 mehr als verdreifacht.
- Die vergleichsweise milden Winter der vergangenen Jahre führten zu einer Überwinterung virustragender Blattläuse; die Populationsgröße wurde durch ausbleibende Kälte und Frost nicht reduziert. Im Frühjahr flogen die Blattläuse in die jungen empfindlichen Bestände ein und setzten Infektionsherde.
- Bisheriger Nanovirus-Befall blieb unentdeckt, weil spezifische Verfahren zum Nachweis der Nanoviren nicht vorhanden waren. Sobald ein oder mehrere andere Viren in einer Probe nachgewiesen waren, wurde - in der Annahme, die Schadursache sei bereits gefunden - die Suche nach weiteren Viren abgebrochen.
Bekämpfungs- und Kontrollmöglichkeiten
- Die Bekämpfung eines bereits vorhandenen Befalls ist nicht möglich, da es keinerlei Pflanzenschutzmittel gegen Viren gibt.
- Insektizidspritzungen: Sichere Bekämpfungsstrategien existieren nicht; auch Spritzungen gegen Blattläuse können einen Befall nicht verhindern, allenfalls können sie zur Schadensbegrenzung beitragen.
- Die Kontrolle der Bestände auf Blattläuse ab dem Auflaufen ist sehr wichtig, denn insbesondere früher Befall der jungen, anfälligen Pflanzen kann zu Totalausfall führen. Außerdem kann nur eine frühzeitige Blattlausbekämpfung die Ausbreitung im Bestand reduzieren.
- Einflussnahme über den Saattermin: Ausgesät werden sollte früh im Jahr oder spät nach Zusammenbruch der Blattlauspopulationen.
- Beizungen sind nicht zugelassen, obwohl Saatgutbeizung eine Frühinfektion verhindern kann. Alternative Produkte für den Bioanbau, z. B. basierend auf Pyrethrum, Kaliseife oder Knoblauchextrakten, zur nachhaltigen Blattlausbekämpfung sind nur bedingt geeignet (Ziebell, JKI).
- Wichtig ist das Unterbrechen der Infektionskette, d. h. es dürfen keine Nanovirus-anfälligen Zwischenwirte angebaut werden; auch Greeningflächen müssen frei sein von Wirtspflanzen. Leguminosen, die nicht anfällig gegenüber Nanoviren sind, haben Vorrang - allerdings können diese Kulturen von anderen Viren infiziert werden.
- Geachtet werden sollte auf krautige Leguminosen, die den Winter überdauern wie z. B. Luzerne, Weißklee, Wiesenrotklee; sind sie mit Nanoviren infiziert, stellen sie eine andauernde Infektionsquelle dar.



